
| A、紫色石蕊试液 | B、氢氧化钠溶液 |
| C、金属钠 | D、水 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
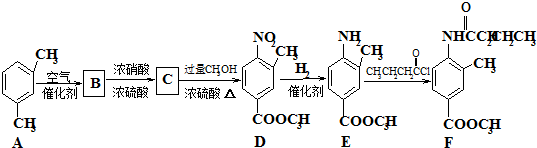
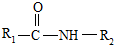 在一定条件下可水解为
在一定条件下可水解为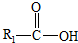 和R2-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是
和R2-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 金属 质量/g | 金属状态 | C(H2SO4) /mol?L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 预期的实验目的或结论 |
| A | 对某白色固体进行焰色反应实验,火焰呈黄色 | 该物质含钠元素 |
| B | 将SO2气体通入某红色溶液中,溶液褪色 | 该溶液一定为品红溶液 |
| C | 蔗糖溶液中加入少量稀硫酸、加热,然后加入银氨溶液再加热 | 验证蔗糖在强酸性条件下是否发生水解 |
| D | 除去苯中混有的少量苯酚 | 加入浓溴水后过滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| B、能使润湿的淀粉KI试纸变成蓝色的物质一定是C12 |
| C、某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| D、HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
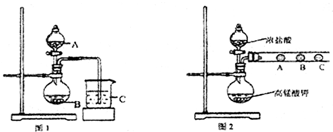
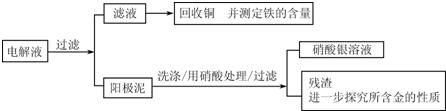
| 序号 | 反应 | 平衡常数 |
| 1 | Au+6HNO3?Au(NO3)3+3NO2↑+3H2O | ≤1 |
| 2 | Au3++4Cl-?Au4Cl4- | ≥1 |
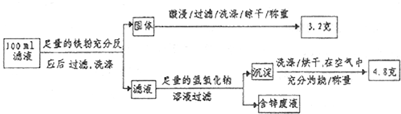
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| O2 |
| H2O |
| A、①③ | B、③④ |
| C、①②④ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
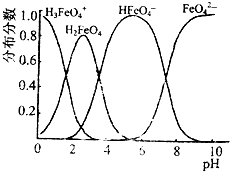 高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:
高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com