
ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目________________________________________________________________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
图中是部分短周期元素原子半径与原子序数的关系图。则下列说法不正确的是双选) )。
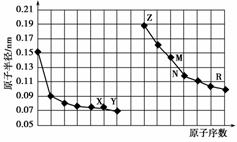
A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
B.简单离子的半径:X>Z>M
C.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z单质不能从M与R元素构成的盐溶液中置换出单质M
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃和1.01×105 Pa时,反应:2N2O5(g)===4NO2(g)+O2(g) ΔH=56.76 kJ·mol-1自发进行的原因是( )
A.是吸热反应
B.是放热反应
C.是熵减小的反应
D.熵增大效应大于能量效应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断可能合理的是( )
A.Fe3+、O2、H2O2三种微粒只具有氧化性,没有还原性
B.木炭与浓硝酸反应可能生成CO和NH4NO3
C.因为SO2具有还原性,所以不能用浓H2SO4干燥SO2
D.Cl2转变为HClO时一定需要加入氧化剂才能实现
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+
Sn2++2Fe3+===2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+
查看答案和解析>>
科目:高中化学 来源: 题型:
铋(Bi)位于元素周期表中ⅤA 族,其价态为+3时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应的现象如表所示:
| 加入 溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI淀粉溶液 |
| 实验 现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
则NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为( )
A.I2、H2O2、KMnO4、NaBiO3
B.H2O2、I2、NaBiO3、KMnO4
C.NaBiO3、KMnO4、H2O2、I2
D.KMnO4、NaBiO3、I2、H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
将FeSO4溶液的pH调节至7左右,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知甲烷隔绝空气在不同温度下可能发生如下两个裂解反应:
①CH4(g)→C(s)+2H2(g)
②2CH4(g)→C2H2(g)+ 3H2(g)
3H2(g)
某同学为了得到用天然气制取炭黑的允许温度范围和最佳温度,在图书馆查到如下热力学数据:
反应①的ΔH(298 K)=74. 848kJ·mol-1,
848kJ·mol-1,
ΔS(298 K)=80.674 J·mol-1·K-1;
反应②的ΔH(298 K)=376.426 kJ·mol-1,
ΔS(298 K)=220.211 J·mol-1·K-1。
已知焓变和熵变随温度变化很小。请帮助这位同学解决如下问题:
(1)制取炭黑的反应是___________(填“高温”或“低温”)自发反应。
(2)通过计算判断制取炭黑的反应在常温下能否自发进行。
(3)求制取炭黑的允许温度范围。
查看答案和解析>>
科目:高中化学 来源: 题型:
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )
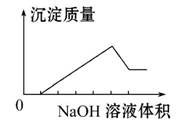
A.Mg2+、Al3+、Fe2+ B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+ D.只有Mg2+、Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com