
【题目】单萜类化合物香叶醇是香精油的主要成分之一。在酸性溶液中,香叶醇可以转化为环状单萜α—松油醇:
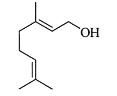
![]()
关于香叶醇和α—松油醇,下列说法正确的是( )
A.香叶醇能在铜丝催化下和氧气氧化生成醛,但α—松油醇不能
B.两者互为同分异构体,分子式是C10H20O
C.两者分子中所有原子均处于同一平面
D.两者均能使溴的四氯化碳溶液褪色,是发生消去反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,等物质的量的N2和CO所含分子数均为NA
B.将含0.l mol FeCl3的饱和溶液制成胶体后,生成的Fe(OH)3胶粒数目为0.1NA
C.常温常压下,lmolNa 加热后生成的Na2O、Na2O2混合物中阴离子数目一定为0.5NA
D.1molFe与足量水蒸气在高温下充分反应后失电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X与W同主族,Y原子的最外层电子数是其内层电子数的3倍,0.1 mol Z单质与足量盐酸反应产生H2的体积为3.36 L(折算成标准状况),W在元素周期表中的主族序数比其周期数大1。下列说法正确的是( )
A.XY2属于离子化合物
B.X的一种单质在高温下与WY2反应可制得W单质
C.原子半径:r(Z)>r(W)>r(Y)>r(X)
D.W的简单气态氢化物的热稳定性比Y的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是
A. KClO3在反应中得到电子 B. ClO2是还原产物
C. H2C2O4发生氧化反应 D. 1 molKClO3参加反应有2mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境、科学、技术密切相关。下列有关说法中正确的是( )
A.华为首款5G手机搭载了智能的7nm制程SoC麒麟980芯片,此芯片主要成分是二氧化硅
B.用于制作N95型口罩的“熔喷布”主要原料是聚丙烯,聚丙烯的分子长链上无支链
C.国产飞机C919用到的氮化硅陶瓷是传统有机非金属材料
D.侯氏制碱法的工艺过程中应用了物质溶解度的差异
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成C的含氧化合物。请回答下列问题:
(1)在Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”(指能量相同的原子轨道在全满、半满、全空状态时,体系的能量最低),该原子的外围电子排布式为__。
(2)在第四周期所有元素中,基态原子未成对电子数最多的元素是__(填元素符号)。
(3)金属晶体热导率随温度升高会降低,其原因是__。
(4)铜的焰色反应呈___。在现代化学中,常用于区分晶体与非晶体的方法为___。
(5)Mn和Co的熔点较高的是___,原因___。
(6)钴晶胞和白铜(铜镍合金)晶胞分别如图1、2所示。

①钴晶胞堆积方式的名称为__;
②已知白铜晶胞的密度为dg·cm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为__pm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业含铜废料含有 Cu、CuO、CuS、CuSO4 等成分,利用该含铜废料可生产硝酸铜晶体[Cu(NO3)2·3H2O],生产的工艺流程如图所示,请回答下列问题:

(1)“焙烧”过程中生成的废气中有害气体的成分是______________。
(2)“酸化”过程为加快反应速率,可采用的措施有___________________________(写出一条即可)。
(3)若试剂 a 可以是____________,试剂b的作用是______________________________________。
(4)“反应”一步中使用 20% HNO3 和 10% H2O2,整个过程无红棕色气体产生,则发生反应的离子方程式为______________________________________;若该步骤只使用 20% HNO3,随着反应的进行,温度升高,出现大量红棕色气体,则还原剂与氧化剂的物质的量之比为_______________。
(5)“系列操作”中应包含____________、______________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染物主要成分是SO2、NO2、NO、CO及可吸入颗粒等,主要来自于燃煤、机动车尾气和工业废气,会导致雾霾、酸雨等。
(1)汽车的三元催化转化器中,在催化剂作用下NO和CO转化为无毒气体,反应的化学方程式是: 2CO+2NO ![]() 2CO2+N2,该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式),当生成2mol N2时,转移电子的物质的量是____________________。
2CO2+N2,该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式),当生成2mol N2时,转移电子的物质的量是____________________。
(2)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2转化为SO42―。已知0.1mol/L 100mLNaClO溶液,可以恰好吸收0.01moL SO2,则反应的离子方程式是______________________。
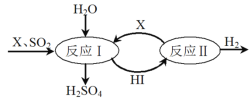
(3)SO2通过如图过程既能制得H2SO4又能制得H2。图中可循环利用的物质X是_________(填化学式),制得H2SO4的化学方程式是__________________________。
(4)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:NO2+NO+2NaOH===2NaNO2+H2O 2NO2+2NaOH===NaNO2+NaNO3+H2O
现有V L某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。所用烧碱溶液的物质的量浓度至少为________ mol·L1。若所得溶液中c(![]() )∶c(
)∶c(![]() )=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=____________________。
)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组将纯净的SO2气体缓缓的通入到盛有25mL0.1mol· L-1的Ba(NO3)2溶液中,得到BaSO4沉淀。为探究该反应中的氧化剂,该小组提出了如下假设:
假设Ⅰ:溶液中的NO3-;
假设Ⅱ:________________。
(1)该小组设计了以下实验验证了假设Ⅰ成立(为排除假设Ⅱ对假设Ⅰ的干扰,在配制下列实验所用溶液时,应___________________),请填写下表。
实验步骤 | 实验现象 | 结论 | |
实验① | 向盛有25mL0.1mol·L-1BaCl2溶液的烧杯中缓慢通入纯净的SO2气体 | ______ | 假设Ⅰ成立 |
实验② | 向盛有25mL0.1mol· L-1Ba(NO3)2溶液的烧杯中缓慢通入纯净的SO2气体 | ______ | |
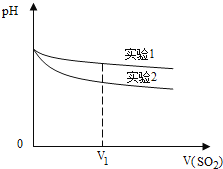
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图。V1时,实验②中溶液pH小于实验①的原因是(用离子方程式表示):________。
(3)验证假设Ⅱ。某同学设计了以下方案,请完成下列表格(可以不填满)。
实验步骤 | 实验现象 | 实验目的 | ||
实验③ | 同实验①步骤 | 同实验①的相关现象 | ______ | |
实验④ | ______ | ______ | ______ | |
(4)查资料知:H2SO3是二元酸(Kl=1.54×10-2,K2=1.02×10-7),请设计实验方案验证H2SO3是二元酸______(试剂及仪器自选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com