
| A. | 加入过量Fe:Fe2+、Fe3+、Cl-、H+ | |
| B. | 加入过量H2O2和稀盐酸:Fe3+、Cu2+、H+、Cl- | |
| C. | 加入过量新制氯水:Fe3+、Cu2+、H+、Cl- | |
| D. | 加入过量CuO:Fe3+、Cu2+、H+、Cl- |
分析 A.Fe过量,反应后溶液中不会存在铁离子;
B.四种离子之间不反应,加入双氧水和稀盐酸也不反应;
C.四种离子之间不富裕,都不与氯水反应;
D.氢离子与氧化铜反应.
解答 解:A.Fe、Fe3+之间发生反应,加入过量Fe后不可能存在大量Fe3+,故A错误;
B.加入过量H2O2和稀盐酸后,Fe2+被氧化成Fe3+,反应后溶液中Fe3+、Cu2+、H+、Cl-可以大量共存,故B正确;
C.加入过量新制氯水,Fe2+被氧化成Fe3+,反应后溶液中Fe3+、Cu2+、H+、Cl-可以大量共存,故C正确;
D.CuO与H+反应,不能大量共存,故D错误;
故选BC.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:多选题
| A. | 分子式为C6H6 | B. | 属于不饱和烃 | C. | 能在空气中燃烧 | D. | 无色无毒的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 证明还原性:I->Fe2+ | 向FeI2和KSCN混合溶液中滴入少量氯水,再加入CCl4,振荡 |
| B | 制备Fe(OH)3胶体 | 向饱和FeCl3溶液中滴加氨水并不断搅拌 |
| C | 分离苯和四氯化碳 | 用分液漏斗进行分液 |
| D | 制取NH3 | 直接加热NH4Cl固体,用向下排空气法收集气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
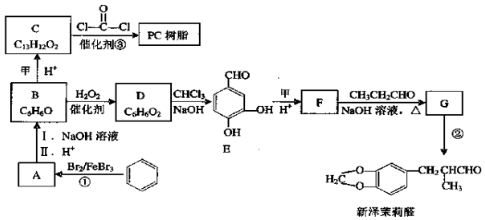
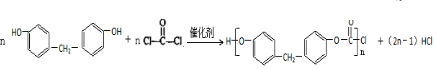
 +H2O
+H2O $\stackrel{H+}{→}$
$\stackrel{H+}{→}$ +H2O
+H2O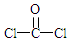 +2ROH$\stackrel{催化剂}{→}$
+2ROH$\stackrel{催化剂}{→}$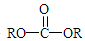 +2HCl
+2HCl .
. .
. .
. .
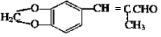
.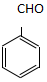 )为原料,选用必要的无机试剂合成
)为原料,选用必要的无机试剂合成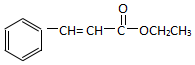 ,写出合成路线
,写出合成路线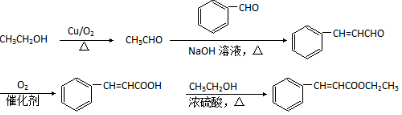 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类和蛋白质都属于高分子化合物 | B. | 苯和聚乙烯均能发生加成反应 | ||
| C. | C5H11Cl有6种同分异构体 | D. | 石油分馏、煤干馏都可得到烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂是热值最高的营养物质,可以制造肥皂和油漆 | |
| B. | 利用二氧化碳制造全降解塑料,符合绿色化学理念 | |
| C. | 脱脂棉、滤纸、蚕丝的主要成分均为纤维素,完全水解能得到葡萄糖 | |
| D. | 酒精、福尔马林用于杀菌消毒的原理都是使蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与浓H2SO4共热170℃ | B. | 乙烯使溴水褪色 | ||
| C. | 甲苯与浓硫酸、浓硝酸混合 | D. | 苯与Cl2一定条件生成六氯环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com