
【题目】下列有关实验原理或操作正确的是

A. 选择合适的试剂,用图1所示装置可分别制取少量CO2、NO和O2
B. 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有足量酸性KMnO4溶液、浓硫酸的洗气瓶
C. 洗涤沉淀时(如图2),向漏斗中加适量水浸没沉淀并搅拌,待水滤尽后重复操作
D. 将碘酒倒入分液漏斗,加适量四氯化碳振荡后静置,可将碘萃取到四氯化碳中
【答案】B
【解析】A.实验室制取二氧化碳可用大理石与稀盐酸在常温下反应,由于二氧化碳密度比空气大,可用向上排空气法收集,可选择图1装置;双氧水在二氧化锰催化作用下制取氧气,选用固液不加热装置,氧气密度比空气大,用向上排空气法收集,可选择图1装置;一氧化氮可以和氧气反应,不能用向上排空气法收集,选项A错误; B.二氧化硫和与酸性高锰酸发生氧化还原反应,可除去二氧化硫,用浓硫酸干燥可得纯净的二氧化碳气体,选项B正确;
C.洗涤沉淀时用玻璃棒引流,注入蒸馏水,直至没过沉淀,然后等待液体从漏斗底部流走,重复步骤两到三次,不能用玻璃棒搅拌,选项C错误;D.乙醇和水是互溶的,不能用乙醇做碘水分离的萃取剂,选项D错误。答案选B。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E和F表示含有10个电子的微粒,请回答:
(1)A离子为单核离子且A原子在所在周期中原子半径最大,A离子是______;(填离子符号)
(2)D是由两种元素组成的分子,其水溶液呈碱性,D的结构式是_______________;
(3)向含B微粒溶液中加入含F微粒溶液,先出现白色沉淀,继续加入含F微粒溶液沉淀溶解,写出该过程的离子方程式__________________________________
(4)向含E微粒溶液中加入含F微粒溶液,并加热生成 C和D,写出该离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是

A. 反应①为取代反应,有机产物与水混合浮在上层
B. 反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C. 反应③为取代反应,有机产物是一种烃
D. 反应④中1 mol苯最多与3 mol H2发生加成反应,因为每个苯分子含有三个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“3G”手机出现后,以光导纤维为基础的高速信息通道尤显重要。下列物质中用于制造光导纤维的材料是
A. 铜合金 B. 陶瓷 C. 聚乙烯 D. 二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠、氢氧化钠、碳酸钠和碳酸氢钠是生活中常见的物质.请回答下列问题.
(1)等质量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者后者(填>、<或=).
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为 .
(3)除去NaHCO3溶液中的少量Na2CO3 , 方法是: , 离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中能量变化如图所示(图中E表示正反应的活化能,E2表示逆反应的活化能。下列有关叙述正确的是
2SO3(g)反应过程中能量变化如图所示(图中E表示正反应的活化能,E2表示逆反应的活化能。下列有关叙述正确的是
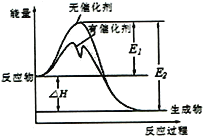
A. 该反应的逆反应为放热反应,升高温度可提高活化分子的百分数
B. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
C. 该反应中,反应物的总键能大于生成物的总键能
D. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH =-2akJ·mol-1
2SO3(g) ΔH =-2akJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
X | Y | Z | |
① | Cu | CuO | Cu(OH)2 |
② | CH3CH2OH | CH3CHO | CH2═CH2 |
③ | Na2CO3 | NaOH | NaHCO3 |
④ | CaCO3 | CaO | Ca(OH)2 |
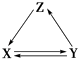
A.②③
B.③④
C.②④
D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下图为氢氧燃料电池的构造示意图,由此判断X极为电池的_____极,OH—向______(填“正”或“负”)极作定向移动,Y极的电极反应方程式为________,电路中每转移0.2mol电子,标准状况下正极上消耗气体的体积是_______ L。
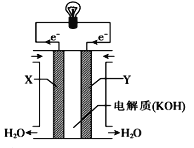
(2)为了验证Fe3 +与Cu2+氧化性强弱,设计一个装置,下列装置既能产生电流又能达到实验目的的是__________。

(3)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4 + 2H2O![]() Pb + PbO2 + 2H2SO4。铅蓄电池放电时正极是______(填物质化学式),该电极质量_____(填“增加”或“减少)。若电解液体积为2L(反应过程溶液体积变化忽略不计),放电过程中外电路中转移3mol电子,则硫酸浓度由5mol/L下降到________mol/L。
Pb + PbO2 + 2H2SO4。铅蓄电池放电时正极是______(填物质化学式),该电极质量_____(填“增加”或“减少)。若电解液体积为2L(反应过程溶液体积变化忽略不计),放电过程中外电路中转移3mol电子,则硫酸浓度由5mol/L下降到________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com