
【题目】Ⅰ、甲醇既是重要的化工原料,又可作为燃料,利用CO和H2在催化剂作用下可合成甲醇(g)。
(1)已知相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
合成甲醇(g)的热化学方程式为______________________________________________。
(2)500K、101KPa条件下,反应过程中测得n(CO)、n(H2)、n(CH3OH)随时间t变化的关系如图甲所示。现保持其它条件不变,起始只改变温度,在改变的这个温度下反应至t1时刻,此时n(H2)比图象中的值大,那么该温度可能是________。
A、700K B、373K C、以上均不对
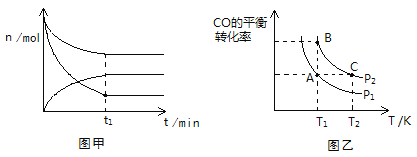
(3)在一容积可变的密闭容器中充入1 mol CO和2 mol H2,发生反应并达到平衡,CO的平衡转化率随温度(T)和压强(P)的变化曲线如图乙所示。P1、P2的大小关系为________;A、B、C三点的平衡常数(K)大小关系为______________________。
Ⅱ、可逆反应:①X(g)+2Y(g)![]() 2Z(g);②2M(g)
2Z(g);②2M(g)![]() N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间放有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间放有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
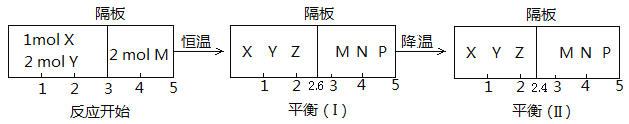
(4)反应①的正反应ΔH______0(填“>”或“<”)。
(5)反应开始时体系的压强与达平衡(Ⅰ)时体系的压强之比为_________(用分数表示)。
(6)在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数(Ⅰ)______(Ⅱ)。
A、大于 B、小于 C、等于 D、无法确定
【答案】 CO(g)+2H2(g) ![]() CH3OH(g) △H= —99kJ/mol AB P2>P1 KA=KB>KC < 6/5 D
CH3OH(g) △H= —99kJ/mol AB P2>P1 KA=KB>KC < 6/5 D
【解析】I. (1). 根据题意可知,利用CO和H2在催化剂作用下合成甲醇(g)的化学方程式为:CO(g)+2H2(g) ![]() CH3OH(g),反应热=反应物的键能总和-生成物的键能总和,则△H=(1076+2×436)kJ/mol-(3×413+343+465)kJ/mol=-99kJ/mol,故答案为:CO(g)+2H2(g)
CH3OH(g),反应热=反应物的键能总和-生成物的键能总和,则△H=(1076+2×436)kJ/mol-(3×413+343+465)kJ/mol=-99kJ/mol,故答案为:CO(g)+2H2(g) ![]() CH3OH(g) △H=-99kJ/mol;
CH3OH(g) △H=-99kJ/mol;
(2). 保持其它条件不变,起始只改变温度,在改变的这个温度下反应至t1时刻,n(H2)比图象中的值大,反应CO(g)+2H2(g) ![]() CH3OH(g) △H=-99kJ/mol为放热反应,若温度高于500K,升高温度平衡逆向移动,n(H2)比图象中的值大,若温度低于500K,反应速率减慢,则t1时刻尚未达到平衡状态,n(H2)也比图象中的值大,故答案选:AB;
CH3OH(g) △H=-99kJ/mol为放热反应,若温度高于500K,升高温度平衡逆向移动,n(H2)比图象中的值大,若温度低于500K,反应速率减慢,则t1时刻尚未达到平衡状态,n(H2)也比图象中的值大,故答案选:AB;
(3). CO(g)+2H2(g) ![]() CH3OH(g)为气体体积减少的反应,增大压强平衡正向移动,CO的转化率升高,因P2条件下CO的转化率大于P1条件下CO的转化率,所以P2>P1,CO(g)+2H2(g)
CH3OH(g)为气体体积减少的反应,增大压强平衡正向移动,CO的转化率升高,因P2条件下CO的转化率大于P1条件下CO的转化率,所以P2>P1,CO(g)+2H2(g) ![]() CH3OH(g)为放热反应,升高温度平衡逆向移动,CO的转化率降低,因T2条件下CO的转化率小于T1条件下CO的转化率,则T2>T1,又因温度相同时平衡常数相等,则A、B、C三点的平衡常数(K)大小关系为:KA=KB>KC,故答案为:P2>P1;KA=KB>KC;
CH3OH(g)为放热反应,升高温度平衡逆向移动,CO的转化率降低,因T2条件下CO的转化率小于T1条件下CO的转化率,则T2>T1,又因温度相同时平衡常数相等,则A、B、C三点的平衡常数(K)大小关系为:KA=KB>KC,故答案为:P2>P1;KA=KB>KC;
II. (4). 据图可知,平衡(I)降低温度达到平衡(II)时,隔板由2.6处移至2.4处,左室气体的总物质的量减少,说明降低温度反应X(g)+2Y(g)![]() 2Z(g)正向移动,因降低温度平衡向放热反应方向移动,所以该反应的正反应为放热反应,△H<0,故答案为:<;
2Z(g)正向移动,因降低温度平衡向放热反应方向移动,所以该反应的正反应为放热反应,△H<0,故答案为:<;
(5). 右室进行的反应2M(g)![]() N(g)+P(g)为等体积的可逆反应,达到平衡(I)时,右室气体的总物质的量仍为2mol,因压强与气体体积成反比,则由图可以看出,反应开始时体系的压强与达平衡(Ⅰ)时体系的压强之比为:
N(g)+P(g)为等体积的可逆反应,达到平衡(I)时,右室气体的总物质的量仍为2mol,因压强与气体体积成反比,则由图可以看出,反应开始时体系的压强与达平衡(Ⅰ)时体系的压强之比为:![]() =
=![]() ,故答案为:6/5;
,故答案为:6/5;
(6). 右室中气体的总物质的量始终不变,但由于降低温度,反应2M(g)![]() N(g)+P(g)的平衡会发生移动,导致M的含量变化,所以在平衡(I)和平衡(II)中M的体积分数不相等,又因为无法确定2M(g)
N(g)+P(g)的平衡会发生移动,导致M的含量变化,所以在平衡(I)和平衡(II)中M的体积分数不相等,又因为无法确定2M(g)![]() N(g)+P(g)是放热反应还是吸热反应,所以无法确定降低温度时平衡的移动方向,因此无法判断在平衡(Ⅰ)和平衡(Ⅱ)中M的体积分数大小,故答案为:D。
N(g)+P(g)是放热反应还是吸热反应,所以无法确定降低温度时平衡的移动方向,因此无法判断在平衡(Ⅰ)和平衡(Ⅱ)中M的体积分数大小,故答案为:D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
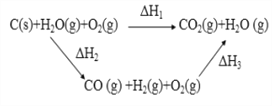
A. ΔH1=ΔH2+ΔH3
B. ΔH1<0 、 ΔH2>0 、 ΔH3<0
C. 将煤转化为 H2(g) 和 CO(g)后燃烧比煤直接燃烧放出热量多
D. 将煤转化为水煤气后再燃烧,从提高煤燃烧利用率看是得不偿失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
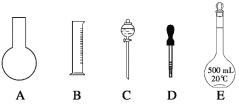
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 ____________________。
(2)在容量瓶的使用方法中,下列操作不正确的是____________。
A.使用容量瓶前检验是否漏水。
B.容量瓶用水洗净后,再用待配溶液洗涤。
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为_______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.10 mol/L甲胺的溶液中滴加0.10 mol/L盐酸时混合溶液的pH与相关微粒的浓度关系如图所示。已知:甲胺(CH3NH2)类似于氨,但碱性稍强于氨。下列说法不正确的是

A. 甲胺在水中的电离方程式CH3NH2+H2O![]() CH3NH3++OH—
CH3NH3++OH—
B. b点对应的加入盐酸的体积小于20mL
C. 将等物质的量的CH3NH2和CH3NH3Cl一起溶于蒸馏水,得到对应a点的溶液
D. 常温下,甲胺的电离常数为Kb,则pKb=—lgKb=3.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 氯化钠水溶液在电流的作用下电离出Na+和Cl
B. 硫酸钡难溶于水,但硫酸钡属于电解质
C. 二氧化碳溶于水能导电,故二氧化碳属于电解质
D. 硫酸钠在水中的电离方程式可表示为Na2SO4![]() 2Na++S6++4O2
2Na++S6++4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示联苯双酯能增强肝脏解毒功能,减轻肝脏的病理损伤,促进肝细胞再生并保护肝细胞,从而改善肝功能。合成联苯双酯的工艺路线如下:
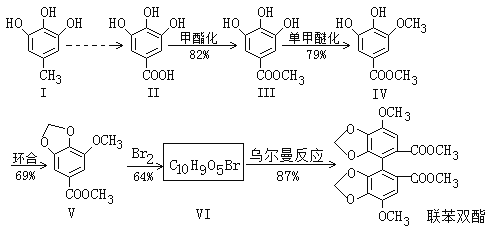
已知:![]()
回答下列问题:
(1)化合物Ⅲ中的官能团名称为______________,该化合物的核磁共振氢谱中有_____组峰。
(2)Ⅴ→Ⅵ的反应类型为______________。写出一定条件下Ⅴ→Ⅵ的化学方程式:____________________。
(3)写出比Ⅴ多2个H原子,且符合下列条件的任意两种同分异构体的结构简式:_________________
①苯环上的一氯代物只有1种;
②能发生银镜反应;
③水解产物之一能与FeCl3溶液发生显色反应;
(4)根据题目中的相关信息并结合已学知识,写出Ⅰ→Ⅱ的合成路线:_________________,该合成路线为何要经过多步而不是一步完成,目的是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
三位分别来自瑞士、美国、英国的科学家因发展“冷冻电子显微镜技术对溶液中的生物分子进行高分辨率结构测定”所做出的贡献而获得2017年诺贝尔化学奖。含有有机杂化锌、锗以及砷等金属的硒化物具有离子交换、催化、吸附、半导体等性能,显示出良好的应用前景。回答下列问题:
(1)锌基态原子核外电子排布式为_________。位于元素周期表五个分区中的________区。
(2)元素锗与砷中,第一电离能较大的是________ (填元素符号,下同),基态原子核外未成对电子数较少的是________。
(3)元素砷与氮同主族,二者的氢化物中熔沸点较高的是_________,原因是________。
(4)H2SeO3分子中Se 原子的杂化形式为________,H2SeO4的酸性比H2SeO3强,原因是________ 。
(5)气态SeO3分子的立体构型为______,与SeO3互为等电子体的一种离子为_____(填离子符号)。
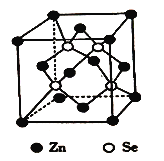
(6)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为_____,若该晶胞密度为ρg/cm3,硒化锌的摩尔质量为Mg/mol。用NA代表阿伏伽德罗常数的数值,则晶胞参数α为_____nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5L 1mol/L的FeCl3与0.2L 1mol/L的KCl溶液中,Cl-的物质的量浓度之比为 ( )
A. 5:2 B. 1:1 C. 3:1 D. 1:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com