
【题目】人体血液里Ca2+的浓度一般采用g/cm3来表示(即1cm3血样中含有的Ca2+的质量)。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。
某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(步骤1:配制KMnO4标准溶液)
如图是配制100mLKMnO4标准溶液的过程示意图。
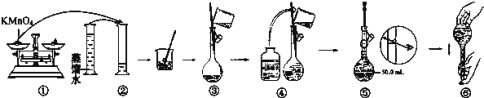
(1)请你观察图示判断,其中不正确的两项操作有___(填序号);
(2)其中确定100mL溶液体积的仪器是____。
(3)如果用图示的操作所配制的溶液进行实验,在其他操作正确的情况下,所配制的溶液浓度将___(填“偏大”或“偏小”)。
(步骤2:测定血液样品中Ca2+的浓度)
抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mLKMnO4溶液。
(4)写出草酸与酸性KMnO4溶液反应的离子方程式____。
(5)滴定的终点为____。
(6)经过计算,血液样品中Ca2+的浓度为____g/cm3。
【答案】②⑤ 100mL容量瓶 偏小 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 滴入最后一滴KMnO4溶液时,溶液由无色变为紫红色,且半分钟内不褪色 1.2×10-3
【解析】
(1)根据配制一定物质的量浓度的溶液的操作步骤确定不正确的操作;
(3)根据c=![]() 判断误差。
判断误差。
(4)根据电子守恒写出草酸与酸性KMnO4溶液反应的离子方程式。
(5)KMnO4溶液是紫红色的,可以用KMnO4溶液的颜色变化确定滴定的终点。
(6)根据关系式5Ca2+——5C2O42-——2MnO4-,计算血液样品中Ca2+的浓度。
(1)量筒只能量取溶液,不能稀释或溶解药品;定容时,视线要与凹液面最低处相切,所以错误为②⑤,故答案为:②⑤;
(2)配制100mL溶液需要100mL容量瓶,所以确定100mL溶液体积的仪器是100mL容量瓶,故答案为:100 mL容量瓶;
(3)根据c=![]() 判断误差,如果V偏大或n偏小,则配制溶液浓度偏小,如果n偏大或V偏小,则配制溶液浓度偏大,仰视时溶液体积偏大,则配制溶液浓度偏小,故答案为:偏小;
判断误差,如果V偏大或n偏小,则配制溶液浓度偏小,如果n偏大或V偏小,则配制溶液浓度偏大,仰视时溶液体积偏大,则配制溶液浓度偏小,故答案为:偏小;
(4)草酸具有还原性,高锰酸钾具有强氧化性,二者发生氧化还原反应生成锰离子、二氧化碳和水,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(5)滴定终点为:滴入最后一滴KMnO4溶液时,溶液由无色变为紫红色,且半分钟内不褪色,故答案为:滴入最后一滴KMnO4溶液时,溶液由无色变为紫红色,且半分钟内不褪色;
(6)得到关系式为5Ca2+——5C2O42-——2MnO4-,设钙离子的质量为x,
5Ca2+——5C2O42-——2MnO4-,
200g 2mol
x 0.020mol/L×0.012mL
x=![]() =0.024g,钙离子浓度=
=0.024g,钙离子浓度=![]() =1.2×10-3g/mL,故答案为:1.2×10-3。
=1.2×10-3g/mL,故答案为:1.2×10-3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】结合元素周期表,完成下列问题。
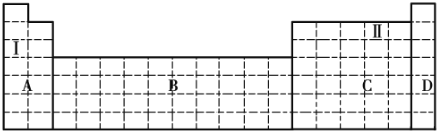
(1)在元素周期表中全部是金属元素的区域为____________(填序号)。
a.A b.B c.C d.D
(2)Ⅰ和Ⅱ元素形成的化合物的化学式为__________________。
(3)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中表面都会生成致密的氧化膜,乙元素原子核外第三层与第一层上的电子数相等。
①将甲、乙两元素的元素符号填写在上面元素周期表中对应的位置__________。
②甲、乙两元素中,金属性较强的是__________(填元素名称),可以验证该结论的实验是_______________(填序号)。
a.将在空气中放置已久的这两种元素的单质分别放入热水中
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子总数与X、W原子的电子总数之比为5:4。下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.Y的简单气态氢化物的热稳定性比Z的强
C.由X、Z组成的化合物与由Z、W组成的化合物只能发生化合反应
D.由X、Y、Z三种元素组成的化合物可以是酸、碱或盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值用 NA 表示。下列说法中正确的是( )
A.33.6L 丙烯(标准状况)与足量 HCl 发生加成反应,生成 1-氯丙烷个数为1.5NA
B.14g 分子式为CnH2n 的链烃中含有的C—H 键的数目为 NA
C.2mol 冰醋酸与 4mol 乙醇一定条件下充分反应,生成乙酸乙酯个数为 2NA
D.1L lmol/L 的葡萄糖溶液中,溶质所含羟基的个数为 5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷(A)的结构特殊,根据如下转化判断下列说法正确的是( )
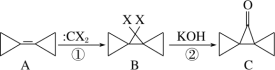
A.反应①、②分别是加成反应和消去反应
B.有机物A 的二氯代物有 4 种(不考虑立体异构)
C.有机物 B 的所有原子都在一个平面内
D.有机物C 的同分异构体中,同时含有苯环和羟基的有 5 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为几种短周期元素的性质:
元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径 | 66 | 160 | 152 | 110 | 99 | 186 | 70 | 88 |
最高化合价 |
|
|
|
|
|
|
| |
最低化合价 |
|
|
|
|
下列有关上述元素的说法正确的是
A.元素⑤的氢化物的沸点高于元素①的氢化物的沸点
B.②⑦形成的化合物为共价化合物
C.上述八种元素中,最高价氧化物对应水化物的酸性最强的是元素⑤
D.元素⑧位于周期表中第3周期ⅢA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究有机物A的组成与结构,某同学进行如下实验。
i.将9.0gA 在足量氧气中充分燃烧,并使其产物依次缓缓通过足量的浓硫酸和碱石灰,发现两者分别增重5.4g和13.2g。
ii.通过质谱法测得其相对分子质量为90。
ili.通过红外光谱法测得A中含有—OH和—COOH。
请回答下列问题。
(1)9.0gA完全燃烧生成水的物质的量是____________mol。
(2)A的实验式是____________。
(3)A的分子式是____________。
(4)在一定条件下,若两个A分子可以反应得到一个六元环的分子,则A的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值)
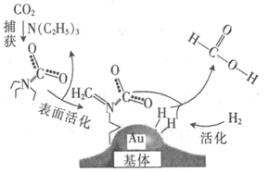
A.标准状况下,22.4 L CO2中所含的电子数目为16NA
B.10.1 g N(C2H5)3中所含的极性共价键数目为2.1NA
C.2 mol Au与2 mol H2中所含的分子数目均为2NA
D.100 g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应中,不属于取代反应的是
A.![]() +Cl2
+Cl2![]()
![]() +HCl
+HCl
B.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.ClCH2CH===CH2+ NaOH![]() HOCH2CH===CH2+NaCl
HOCH2CH===CH2+NaCl
D.![]() +HO—NO2
+HO—NO2![]()
![]() +H2O
+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com