
分析 【提出假设】Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag、Fe3+具有氧化性,能氧化Ag,还可能Fe3+和酸性条件下的NO3-都能氧化Ag;
(1)①依据配制溶液1.5mol/L的Fe(N03)3 落液100mL可以计算得到硝酸铁物质的量为0.15mol,所以需要晶体质量=0.15mol×404g/mol=60.6g;配制溶液的过程和步骤分析回答需要的仪器;
②硝酸铁溶液显酸性的原因是铁离子水解;
③银和稀硝酸反应生成硝酸银、一氧化氮和水,一氧化氮遇空气中的氧气反应生成红棕色气体二氧化氮;
(3)假设2中,铁离子的氧化性和铁离子的浓度大小有关,且生成的银离子在溶液中生成氯化银沉淀阻止反应进行,可能是浓度小或阻止反应进行,需要验证亚铁离子的存在证明铁离子是否发生还原反应;
[思考与交流]依据题干信息分析现象,浓溶液中的铁离子和硝酸根离子具有氧化性能够使银溶解,稀溶液中是硝酸根离子的氧化性.
解答 解:【提出假设】假设1:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag;假设2:Fe3+具有氧化性,能氧化Ag;也可能铁离子、酸性条件下的硝酸根离子都能够氧化银,则假设3应该为:Fe3+和酸性条件下的NO3-都能氧化Ag,
故答案为:Fe3+和酸性条件下的NO3-都能氧化Ag;
[验证假设](1)①用淡紫色的Fe(N03)3•9H20晶体(分析纯,Mr=404)配制1.5mol/L的Fe(N03)3 溶液100mL,依据硝酸铁溶质物质的量为0.15mol,所以需要晶体质量=0.15mol×404g/mol=60.6g;配制溶液的过程和步骤分析可知需要的仪器除烧杯、玻璃棒外还必需100ml的容量瓶,胶头滴管,
故答案为:60.6;100 mL容量瓶、胶头滴管;
②测得1.5mol/L的Fe(NO3)3溶液pH约为2说明溶液呈酸性,是铁离子水解的原因,反应的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,
故答案为:Fe3++3H2O?Fe(OH)3+3H+;
③将pH=1的HN03溶液加入到镀有银镜的试管中,振荡,观察到银镜慢慢溶解,产生无色气体并在液面上方变为红棕色,溶液中发生反应的离子方程式应是:3Ag+NO3-+4H+═3Ag++NO↑+2H2O,
故答案为:3Ag+NO3-+4H+═3Ag++NO↑+2H2O;
(3)假设2中,铁离子的氧化性和铁离子的浓度大小有关,且生成的银离子在溶液中生成氯化银沉淀阻止反应进行,可能是浓度小或阻止反应进行,需要验证亚铁离子的存在证明铁离子是否发生还原反应;没有检验是否生成了Fe2+,可能是Fe3+与Ag发生了反应,但生成的Ag+与Cl-形成沉淀阻止了反应继续进行,也可能是FeCl3溶液浓度太小而不能溶解银,所以不同意乙的结论;
故答案为:可能是Fe3+与Ag发生了反应,但生成的Ag+与Cl-形成沉淀阻止了反应继续进行,也可能是FeCl3溶液浓度太小而不能溶解银;
[思考与交流]根据以上信息综合分析可知,浓、稀Fe(NO3)3溶液溶解银镜时的原理情况为:Fe(NO3)3浓溶液中,Fe3+、NO3-都氧化了Ag,而Fe(NO3)3稀溶液中,可能只有NO3-氧化了Ag,
故答案为:Fe(NO3)3浓溶液中,Fe3+、NO3-都氧化了Ag,Fe(NO3)3稀溶液中可能只有NO3-氧化了Ag.
点评 本题考查了物质性质的实验设计、化学实验基本操作方法及其综合应用,题目难度中等,正确分析题干信息明确实验原理为解答关键,注意掌握常见物质性质及化学实验基本操作方法,能够正确书写常见反应的离子方程式.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁与氯气反应 | B. | 次氯酸的分解 | ||
| C. | 乙醇与乙酸的酯化反应 | D. | 甲烷与氧气的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 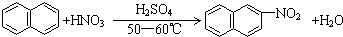 | |
| B. | CH3CH2CH2CHOHCH3$→_{△}^{浓硫酸}$CH3CH2CH=CHCH3+H2O | |
| C. | 2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O | |
| D. | CH3COOH+CH3OH $→_{△}^{浓H_{2}SO_{4}}$ CH3COOCH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有CO2和SO2 | B. | 可能有HBr、CO2 | ||
| C. | 肯定没有HBr、H2S、HCl | D. | 以上结论均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
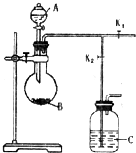 如图是制备二氧化硫制取和吸收装置(加热装置已省略)分液漏斗中是液体反应试剂A,烧瓶中盛反应试剂B.完成下列填空:
如图是制备二氧化硫制取和吸收装置(加热装置已省略)分液漏斗中是液体反应试剂A,烧瓶中盛反应试剂B.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
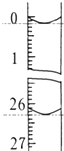 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.15 |
| 第二次 | 25.00 | 0.56 | 30.30 |
| 第三次 | 25.00 | 0.20 | 26.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表分为7个主族、7个副族、1个0族、1个VIII族,共18个纵行 | |
| B. | 己知As元素位于第四周期VA族,故NH3比 AsH3稳定 | |
| C. | 已知Sr元素位于第五周期IIA族,故Sr(OH)2碱性比Mg(OH)2弱 | |
| D. | 副族元素中没有非金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com