
| A. | 对燃烧煤时产生的尾气进行除硫处理 | |
| B. | 往已经酸化的土壤撒石灰中和 | |
| C. | 煤燃烧时鼓入足量空气 | |
| D. | 将煤除硫后再燃烧 |
分析 由题给信息可知绿色化学是预防污染的基本手段,应从源头消除污染,而不是出现污染后再治理.
解答 解:A、对燃煤后的尾气进行除硫处理,是出现污染后再治理,而不是从源头上预防污染,故不符合绿色化学的理念,故A错误;
B、往已经酸化的土壤中撒石灰中和也是出现污染后再治理,而不是从源头上预防污染,故不符合绿色化学的理念,故B错误;
C、燃煤时鼓入足量的空气只能使煤充分燃烧,减少CO的产生,但不能减少粉尘污染和二氧化硫的产生,故不符合绿色化学,故C错误;
D、将煤除硫后再燃烧,从源头上控制了污染的产生,符合绿色化学的理念,故D正确.
故选D.
点评 本题考查环境污染及治理,侧重于化学与环境的考查,有利于培养学生的良好科学素养和树立环保意识,难度不大,注意把握题给信息.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b>c>a | B. | b>a>c | C. | c>b>a | D. | a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 △H=+124kJ•mol-1
△H=+124kJ•mol-1| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | x | 436 |
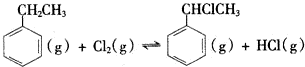 △H2>0
△H2>0
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 |  |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com