
【题目】某金属能与盐酸反应产生氢气,该金属与锌组成的原电池中,锌为负极.该金属为( )
A.铝
B.铜
C.铁
D.镁
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】煤是重要的化石燃料和化工原料,有关煤的综合利用得到广泛深入的研究。其中煤的气化是煤的综合利用的重要途径。
煤的催化气化生成CO,主要反应为①C(s)+CO2(g)![]() 2CO(g)△H
2CO(g)△H
碱金属催化剂显示出了优越的催化性能。Mckee和Chatterji在1975年提出了由碱金属的氧化还原循环的氧传递机理:
②K2CO3(s)+2C(s)![]() 2K(g)+3CO(g) △H1=+899.4kJ/mol
2K(g)+3CO(g) △H1=+899.4kJ/mol
③2K(g)+CO2(g)![]() K2O(s)+CO(g) △H2=-98.4k/mol
K2O(s)+CO(g) △H2=-98.4k/mol
④K2O(s)+CO2(g)![]() K2CO3(s) △H3=-456.0kJ/mol
K2CO3(s) △H3=-456.0kJ/mol
(1)△H=_____________。
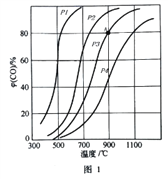
(2)在2L的密闭容器中投入3molC和3molCO2,在催化剂的作用下发生反应①,平衡时CO的气体体积分数φ(CO)随温度和压强的变化曲线如图1所示,根据图像回答问题:
①若在温度为900℃,压强为P的条件下,经过10min反应达到平衡,则0~10min内的反应速率v(CO)为_____________。
②该可逆反应达到平衡状态的标志是_____________ (填字母)
A.v(CO)正=2v(CO2)逆 B.CO2和CO的浓度之比为1∶2
C.容器内的总压强不再随时间而变化 D.混合气体的密度不再随时间而变化
③图中压强的大小顺序_______________,判断理由是_______________。
④可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算(分压=总压×物质的量分数)。反应①在图中A点的总压强为1MPa,则A点的平衡常数Kp=_____________。
(3)化石燃料燃烧易造成污染,“湿式吸收法”利用吸收剂与SO2发生反应从而达到燃料脱硫的目的。下列适合作该法吸收剂的是___________(填序号)。
A.氨水 B.Na2SO4溶液 C.Na2CO3溶液 D.NaHSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某淡黄色粉末可在潜水艇中作为氧气的来源,常被用作供氧剂。根据下图所示转化关系及现象填空:
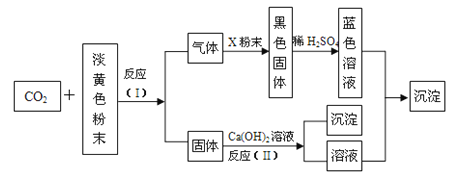
(1)该淡黄色粉末为__________________;
(2)X粉末的名称或化学式为__________________;
(3)反应(I)的化学方程式为______________________________;
(4)反应(II)的化学方程式为_____________________________;
(5)反应(Ⅲ)的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
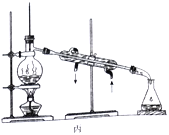
【题目】对下列各实验装置的描述正确的是( )
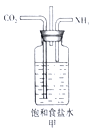


A. 甲装置可用来模拟工业制取NaHCO3,实验时为防止倒吸,应先通入CO2一段时间后再通NH3
B. 乙装置可用来萃取溴水中的溴,放出下层水后,另换洁净的烧怀放出有机层
C. 丙装置可用来分离四氯化碳和苯的混合物,其中直形冷凝管可用球形冷凝管代替
D. 丁装置可用来做喷泉实验,若在水中滴入少量酚酞,实验中可观察到红色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家刚刚发现了某种元素的原子,1个该原子质量是a g,一个12C原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是
①该原子的相对原子质量为12a/b ②m g该原子的物质的量为 m/aNAmol
③该原子的摩尔质量是aNA g ④Wg该原子中含有W/a个该原子
⑤由已知信息可得:NA=12/a
A. ①②④ B. ①③ C. ②③ D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下正丁烷(CH3CH2CH2CH3)易发生两种裂解反应:
Ⅰ.CH3CH2CH2CH3 (g)![]() CH3CH=CH2(g)+CH4(g) △H1=+ 61.31 kJ·mol-1
CH3CH=CH2(g)+CH4(g) △H1=+ 61.31 kJ·mol-1
Ⅱ.CH3CH2CH2CH3(g)![]() CH2=CH2(g)+CH3CH3(g) △H2=-56.00 kJ·mol-1
CH2=CH2(g)+CH3CH3(g) △H2=-56.00 kJ·mol-1
(1)维持体系温度T不变,总压p恒定时,体积为V1 L的正丁烷发生裂解反应,一段时间平衡后气体体积变为V2 L,此时正丁烷的转化率a(正丁烷)=________;维持体系温度不变,向体系中充入一定量的水蒸气(水蒸气在该条件下不参与反应),再次平衡后正丁烷的转化率将________(填“增大”、“不变”或“减小”),原因为____________________________________________________。
(2)一定温度下向体积为2L的密闭容器中充入0.2molCH3CH=CH2和0.5 molCH4发生反应CH3CH=CH2(g) +CH4(g)![]() CH2=CH2(g)+CH3CH3(g) △H3;5 min后达到平衡状态,容器内剩余CH3CH =CH2的物质的量为0.1mol。
CH2=CH2(g)+CH3CH3(g) △H3;5 min后达到平衡状态,容器内剩余CH3CH =CH2的物质的量为0.1mol。
①△H3=________。
②5min内该反应的反应速率v(CH4)=________。
③保持温度不变,向某密闭容器中充入等物质的量的CH3CH =CH2和CH4,平衡后容器内CH4的体积分数为________。
(3)将0.1molCH2=CH2完全燃烧后的气体通入100mL一定浓度的NaOH溶液中,并将所得溶液稀释至1L。最终所得溶液中CO32-、HCO3-、H2CO3 三者所占物质的量分数随原NaOH溶液浓度变化的关系如图所示:
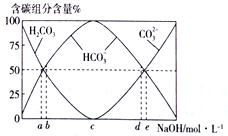
其中图中表示原氢氧化钠溶液浓度为3mol·L-1的是________(选填“a”、“b”、“c”、“d”或“e” ),
(4)以氢氧化钠溶液为电解质溶液,CH2=CH2 燃料电池的负极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
A.K+、MnO4﹣、Na+、Cl﹣
B.K+、Na+、NO3﹣、CO32﹣
C.Na+、H+、NO3﹣、SO42﹣
D.Fe3+、Na+、Cl﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热HCOONa固体,发生的反应有:2HCOONa ![]() Na2C2O4+H2↑ ①
Na2C2O4+H2↑ ①
2HCOONa ![]() Na2CO3 +H2↑+CO↑ ②
Na2CO3 +H2↑+CO↑ ②
Na2C2O4 ![]() Na2CO3 + CO ↑ ③
Na2CO3 + CO ↑ ③
HCOONa加热分解时,固体失重率与温度的关系如右图所示。下列说法正确的是( )

A. T<415℃时,只有反应①发生
B. 反应①、②不可能同时发生
C. 570℃<T<600℃时,残留固体的主要成分是Na2CO3
D. 残留固体中m(Na2C2O4)=m( Na2CO3)时,反应①、②的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2是一种重要的化工原料, 氯气极其相关产品在生产生活中应用广泛。结合氯气的相关知识解决下列问题;
(1)由于氯气贮存运输不方便,工业上常将氯气转化为漂白粉,工业上生产漂白粉的主要化学方程式是______________________;漂白粉的有效成分是(填化学式)_________。漂白粉在空气中长期存放会变质而失效的原理是(用化学方程式说明) _____________。
(2)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 由于氯气有毒所以实验室通常用___________________溶液吸收尾气(填化学式),反应的化学方程式为_____________________。
MnCl2+Cl2↑+2H2O 由于氯气有毒所以实验室通常用___________________溶液吸收尾气(填化学式),反应的化学方程式为_____________________。
(3)氯气是一种常用的消毒剂,新制氯水含多种微粒并表现出不同的性质(用化学式或离子符号填写):
使氯水呈黄绿色的是________;能使AgNO3溶液产生白色沉淀的是________;能使紫色石蕊试液显红色的是________;能使红纸褪色的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com