
下列关于原电池的叙述中正确的是( )
A. 在镁、铝、稀NaOH溶液组成的原电池中,镁是负极,铝是正极
B.在铁、铝、稀硫酸组成的原电池中,电子由铁片通过导线流向铝片
C.在锌、铜、稀硫酸组成的原电池中,当电池工作时,硫酸根离子向正极移动
D.在锌、铜、CuSO4溶液组成的原电池中,负极质量减轻,正极质量增加
科目:高中化学 来源: 题型:
下列说法错误的是
A.除去MgCl2溶液中少量的FeCl3,可选用MgCO3
B.稀硫酸中加入Zn粉,随着反应的进行,溶液中水的电离程度逐渐增大
C.能溶解氧化铝的溶液中可能大量存在:HCO3-、SO42-、NO3-、Na+
D.等物质的量浓度的(NH4)2SO4溶液和(NH4)2CO3溶液中浓度前者大于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
已知空气—锌电池的电极反应为 ( )
锌片:Zn+2OH――2e-=ZnO+H2O;
碳棒:O2+2H2O+4e- =4OH- ,据此判断,锌片是
A.正极,被还原 B.正极,被氧化C.负极,被还原 D.负极,被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
在海水的综合利用中,海水提溴工业是一个重要组成部分,其中一种提溴的工艺是在预先浓缩并酸化的海水中,通入足量氯气,然后使生成的溴与吸收剂SO2反应转化为氢溴酸以达到富集溴元素的目的。在有关上述工艺流程的以下化学用语中,正确的是
A.用电子式表示溴化氢的形成过程为:
B.海水中Br-的电子式为:
C.海水中通入氯气时发生反应的离子方程式为:2NaBr+Cl2=Br2+2NaCl
D.氯离子的结构示意图为:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学反应限度的说法中正确的是( )
A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度
B.当一个可逆反应达到平衡状态时,正反应速率和逆反应速率相等,都等于0
C.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变
D.化学反应的限度不可以通过改变条件而改变
查看答案和解析>>
科目:高中化学 来源: 题型:
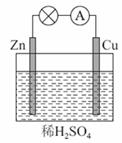
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上描述合理的是( )
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO 向Cu极移动
向Cu极移动
④若有0.5 mol电子流经导线,则可产生0.25 mol气体
⑤电子的流向是:Cu―→Zn
⑥正极反应式:Cu+2e-===Cu2+,发生氧化反应
A.①②③ B.②④⑥ C.③④⑤ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 体积/mL | 50 | 120 | 250 | 306 | 336 |
下列说法正确的是:
A.0~1 min反应速率最大,因为此时反应物浓度最高
B.2~3min反应速率最大,因为此时反应物浓度相对较高,且反应放热使温度升高
C.3~4 min时间内以盐酸的浓度变化来表示的平均反应速率为0.5mol·L-1 ·min-1
D.4~5min反应速率最大,因为此时反应混合物的温度最高
查看答案和解析>>
科目:高中化学 来源: 题型:
与CH2=CH2→CH2Br—CH2Br的变化属于同一反应类型的是( )
A.CH3CHO→C2H5OH B.C2H5Cl→CH2=CH2
 D.CH3COOH→CH3COOC2H5
D.CH3COOH→CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有机物中,既能发生加成反应,又能发生酯化反应,还能被新制Cu(OH)2悬浊液氧化的物质是
A.CH3=CH—CHO B.CH3CH2COOH
C.CH2=CH—COOCH3 D.CH2OH(CHOH)4CHO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com