
如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )。
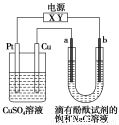
A.X极是电源负极,Y极是电源正极
B.a极的电极反应是2Cl--2e-===Cl2↑
C.电解过程中CuSO4溶液的pH逐渐增大
D.Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源:2014-2015学年浙江省绍兴市高一上学期期中化学试卷(解析版) 题型:选择题
科学家制造出由4个氧原子构成的氧分子,并用质谱仪探测后证实了它的存在。下列关于该氧分子的说法正确的是
A.是氧元素的一种同位素
B.是氧元素的一种单质,分子内含有共价键
C.是一种新的氧化物
D.是臭氧的同分异构体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省温州市十校联合体高一上学期期中联考化学试卷(解析版) 题型:选择题
下面有关Na2CO3 与NaHCO3的性质比较中错误的是
A.相同浓度溶液的pH:Na2CO3>NaHCO3
B.在水中的溶解度:Na2CO3>NaHCO3
C.与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3
D.热稳定性:NaHCO3<Na2CO3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高二10月月考化学试卷(解析版) 题型:选择题
一定温度下,对于反应N2+O2  2NO在密闭容器中进行,下列措施一定能加快反应速率的是:( )
2NO在密闭容器中进行,下列措施一定能加快反应速率的是:( )
A.使压强增大 B.恒容,充入N2
C.恒容,充入He气 D.恒压,充入He气
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高二10月月考化学试卷(解析版) 题型:选择题
下列事实不能用电化学原理解释的是( )
A.常温条件下,在空气中铝不容易被腐蚀
B.镀锌铁片比镀锡铁片更耐腐蚀
C.用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜
D.远洋海轮的尾部装上一定数量的锌板
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高二10月月考化学试卷(解析版) 题型:选择题
镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法正确的是 ( )。
A.电池总反应为Mg+H2O2===Mg(OH)2
B.正极发生的电极反应为H2O2+2H++2e-===2H2O
C.工作时,正极周围海水的pH减小
D.电池工作时,溶液中的H+向负极移动
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高一10月月考化学试卷(解析版) 题型:填空题
(1)100mL0.25 mol·L—1 CaCl2溶液中,Ca2+ 的物质的量为 ;含CaCl2质量为 ;若溶液密度为1.04g/mL,则溶液的质量分数为 。
(2)标准状态下448升氯化氢气体,所含氯化氢的物质的量为 ,将其全部溶解成1升溶液,所得盐酸密度为1.095 g/mL,则盐酸的质量分数为 。盐酸的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高一10月月考化学试卷(解析版) 题型:选择题
下列电离方程式正确的是
A.H2SO4 = 2H+ + S6+ + 4O2- B.H2CO3 = 2H+ + CO32-
C.Ba(OH)2 = Ba2+ + 2OH- D.Na2CO3 = Na2+ + CO32-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:实验题
(12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。
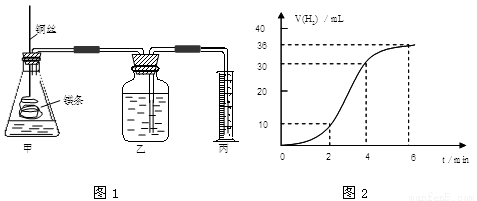
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
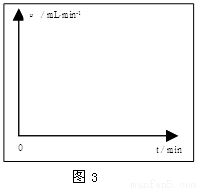
①请在图3的方框中画出上述反应的速率与时间的关系曲线。
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因: 。
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO2- 4对反应没有影响;
原因Ⅱ:Cl-对反应没有影响,而SO2- 4对反应具有阻碍作用;
原因Ⅲ: ;
原因Ⅳ:Cl-、SO2- 4均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ: 。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量 固体 ,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量 固体,观察反应速率是否变化。
通过观察到实验a和实验b现象,从而得出结论。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com