
【题目】有关碱金属性质的叙述错误的是( )
A.随核电荷数的增加,碱金属的熔、沸点降低
B.随核电荷数的增加,碱金属的密度增大
C.锂在氧气中燃烧生成过氧化锂
D.碱金属与水反应生成碱和氢气
科目:高中化学 来源: 题型:
【题目】有一无色溶液,可能含有Fe3+、K+、Al3+、Mg2+、NH![]() 、Cl-、SO
、Cl-、SO![]() 、HCO
、HCO![]() 、MnO
、MnO![]() 中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是( )
中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是( )
A. 肯定有Al3+、Mg2+、NH![]() 、Cl- B. 肯定有Al3+、Mg2+、HCO
、Cl- B. 肯定有Al3+、Mg2+、HCO![]()
C. 肯定有K+、HCO![]() 、MnO
、MnO![]() D. 肯定有Al3+、Mg2+、SO
D. 肯定有Al3+、Mg2+、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述中,正确的是
A.离子化合物可能含共价键
B.共价化合物可能含离子键
C.离子化合物中只含离子键
D.只有活泼金属与活泼非金属间才能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是 ( )
A. 已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B. 已知C(s)+O2(g)=CO2(g) ΔH1 C(s)+1/2O2(g)=CO(g) ΔH2;则ΔH2>ΔH1
C. 已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
D. 放热过程(ΔH<0)或熵增加(ΔS> 0)的过程一定是自发的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。
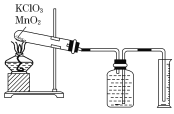
实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
②连接好实验装置,检查装置的气密性。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279.7 mL.
⑤准确称量试管和残留物的质量为15.55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?____________________________________________________________________________。
(2)试管中发生的化学反应方程式为:_______________________________________。
(3)以下是测量收集到气体体积必须包括的几个步骤:
①调整量筒的高度使广口瓶和量筒内的液面高度相同
②使试管和广口瓶内气体都冷却至室温
③读取量筒内液体的体积
这三步操作的正确顺序是___________(请填写步骤代码)。
进行③的实验操作时,若仰视读数,则读取氧气的体积________(填“偏大”、“偏小”或“无影响”)。
(4)实验过程中产生氧气的物质的量是________mol;实验测得氧气的摩尔体积是________(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可形成多种化合物,在工业生产中具有重要价值。 请回答下列问题:
(1)已知拆开1mol H-H 键,1mol N-H键, 1mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,且该反应为可逆反应,则N2与H2反应合成NH3的热化学方程式为_________。
(2)一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行合成氨反应,
①下列描述能说明该可逆反应达到化学平衡状态的有___________
A.容器内气体的密度不变 B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C.容器内的压强不变 D.3v正(H2) =2v逆(NH3)
E. 容器内气体的平均相对分子质量不变
F. 相同时间内有3molH-H键断裂,有6mol N-H键形成
②恒温恒压条件下,为提高合成氨反应中N2和H2的利用率,可以采用的方法有________________。
(3)一定温度下,2L密闭容器中充入0.40 mol N2O4,发生反应:N2O4(g)![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①20s内,v(NO2)=___________,该温度下反应的化学平衡常数数值为_________。
②升高温度时,气体颜色加深,则正反应是_________(填“放热”或“吸热”)反应。
③相同温度下,若开始向该容器中充入0.40 mol NO2,则达到平衡后: c(NO2)_____0.15 mol·L-1(填“>”、 “=”或“<”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com