
【题目】氯气可直接用于自来水的消毒,也可以制取漂粉精、高铁酸钠等物质来对自来水消毒。
(1)氯气通入水中可用来杀菌消毒,其中杀菌消毒的原理是___,其有效成分的电子式是____。
(2)氯气可用来制取漂粉精,但干燥的氢氧化钙与氯气并不易发生反应,氯气只能被氢氧化钙所吸附。为此,在工业上采用加入少许水的消石灰来进行氯化。其原因是____;
(3)漂粉精的消毒能力受水的pH影响,pH较小时的消毒能力____(填“大于”或“小于”) ;pH大时的消毒能力,其原因是______。
(4)用氯气对饮用水消毒副作用多,产生影响人体健康有机氯衍生物。可用氯气制取高铁酸钠净水:___Fe3++____ (__________) + ___Cl2→___FeO42-+____ +___H2O
补全缺项,并配平上述离子方程式;
(5)计算Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气____倍。说明该净水剂与氯气相比较有何优越性 _______________。
【答案】HClO具有强氧化性,能杀菌消毒 ![]() 氯利用这些原料中的游离水分,Cl2+H2O
氯利用这些原料中的游离水分,Cl2+H2O![]() HCl+HClO使生成的酸为消石灰所中和 大于 pH较小时HClO浓度较大 2 16 OH- 3 2 6Cl- 8 0.64 不会产生对人体有危害的有机氯衍生物,还原产物Fe3+可以水解生成Fe(OH)3胶体,吸附杂质净水
HCl+HClO使生成的酸为消石灰所中和 大于 pH较小时HClO浓度较大 2 16 OH- 3 2 6Cl- 8 0.64 不会产生对人体有危害的有机氯衍生物,还原产物Fe3+可以水解生成Fe(OH)3胶体,吸附杂质净水
【解析】
(1)氯水中含有HClO,具有强氧化性,可用于杀菌消毒;
(2)氯气与水反应生成盐酸和次氯酸,可与消石灰发生中和反应;
(3)pH较小时,HClO浓度较大;
(4)从守恒的角度配平方程式;
(5)根据单质质量得到的电子的物质的量计算。
(1)氯水中含有HClO,具有强氧化性,可用于杀菌消毒,HClO的电子式为![]() ;
;
(2)氯气与水反应生成盐酸和次氯酸,发生Cl2+H2O![]() HCl+HClO,可与消石灰发生中和反应;
HCl+HClO,可与消石灰发生中和反应;
(3)pH较小时,HClO浓度较大,具有较强的杀菌消毒能力;
(4)反应Fe元素化合价升高,由+3价变化为+6价,被氧化,Cl元素化合价由0价降低到-1价,反应的方程式为2 Fe3++16OH-+3Cl2=2 FeO42-+6Cl-+8H2O;
(5)FeO42-+3e-+4H2O Fe(OH)3+5OH-,单位质量得到电子![]() =0.018;
=0.018;
Cl2+2e-=2Cl-,单位质量得到电子![]() =0.028,
=0.028,![]() =0.64,
=0.64,
Na2FeO4的消毒效率比氯气低,高铁酸钠代替氯气作净水消毒剂,利用氧化性起到杀菌消毒作用,利用生成的氢氧化铁胶体起到净水作用。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】 盐酸普罗帕酮是一种高效速效抗心律失常药。合成此药的原料D的流程如下:
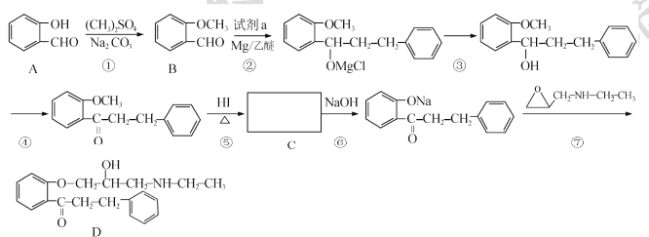
已知: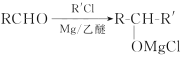
请回答以下问题:
(I)A的化学名称为____,试剂a的结构简式为____。
(2)C的官能团名称为____________。
(3)反应⑤的反应类型为____;反应①和⑤的目的为_______。
(4)满足下列条件的B的同分异构体还有 ___种(不包含B)。其中某同分异构体x能发生水解反应,核磁共振氢谱有4组峰且峰面积比为3:2:2:1,请写出x与NaOH溶液加热反应的化学方程式____。
①能发生银镜反应 ②苯环上有2个取代基
(5)关于物质D的说法,不正确的是____(填标号)。
a.属于芳香族化合物
b.易溶于水
c.有三种官能团
d.可发生取代、加成、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1 mol·L-1己二酸(简写为H2A,电离常数分别为Ka1、Ka2)溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是

A.Ka1=10-4.4
B.曲线II表示的是HA-的物质的最分数δ(X)肋pH的变化关系
C.NaHA溶液中:c(H+)=c(OH-)+2c(A2-)-c(H2A)
D.等物质的量浓度的Na2A与NaHA混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法是指在外加电场作用下,利用阴离子交换膜和阳离子交换膜的选择透过性,使部分离子透过离子交换膜而迁移到另一部分水中,从而使一部分水淡化而另一部分水浓缩的过程。下图是利用电渗析法从海水中获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为石墨电极。

下列有关描述错误的是
A.阳离子交换膜是A,不是B
B.通电后阳极区的电极反应式:2Cl--2e-→Cl2↑
C.工业上阴极使用铁丝网代替石墨碳棒,以减少石墨的损耗
D.阴极区的现象是电极上产生无色气体,溶液中出现少量白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结晶硫酸亚铁部分失水时,分析结果如仍按FeSO4·7H2O的质量分数计算,其值会超过100%。国家标准规定,FeSO4·7H2O的含量:一级品99.50%~100.5%;二级品99.00%~100.5%;三级品98.00%~101.0%。
为测定样品中FeSO4·7H2O的质量分数,可采用在酸性条件下与高锰酸钾溶液进行滴定。
5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O;
2MnO4-+5C2O42-+16H+→2Mn2++10CO2↑+8H2O
测定过程:粗配一定浓度的高锰酸钾溶液1L,然后称取0.200 g 固体Na2C2O4(式量为134.0)放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70℃~80℃。
(1)若要用滴定法测定所配的高锰酸钾溶液浓度,滴定终点的现象是_______________。
(2)将溶液加热的目的是____;反应刚开始时反应速率较小,其后因非温度因素影响而增大,根据影响化学反应速率的条件分析,其原因可能是______________________。
(3)若滴定时发现滴定管尖嘴部分有气泡,滴定结束气泡消失,则测得高锰酸钾浓度_____(填“偏大”“偏小”“无影响”)。
(4)滴定用去高锰酸钾溶液29.50mL,则c(KMnO4)=_____mol/L(保留四位有效数字)。
(5)称取四份FeSO4·7H2O试样,质量均为0.506g,,用上述高锰酸钾溶液滴定达到终点,记录滴定数据
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
V(高锰酸钾)/mL(初读数) | 0.10 | 0.20 | 0.00 | 0.20 |
V(高锰酸钾)/mL(终读数) | 17.76 | 17.88 | 18.16 | 17.90 |
该试样中FeSO4·7H2O的含量(质量分数)为_________(小数点后保留两位),符合国家______级标准。
(6)如实际准确值为99.80%,实验绝对误差=____%,如操作中并无试剂、读数与终点判断的失误,则引起误差的可能原因是:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
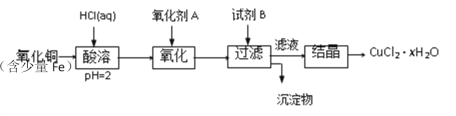
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,Cu2+却不水解。
(1)加热酸溶过程中发生反应的离子方程式有:______
(2)氧化剂A可选用_______(填编号,下同)
①Cl2 ②KMnO4 ③HNO3
(3)要得到较纯的产品,试剂B可选用_______
①NaOH ②FeO ③CuO
(4)试剂B的作用是_______
①提高溶液的pH ②降低溶液的pH
③使Fe3+完全沉淀 ④使Cu2+完全沉淀
(5)从滤液经过结晶得到氯化铜晶体的方法是___________(按实验先后顺序填编号)
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(6)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止、冷却、称量所得无水CuCl2的质量为n g。
方案二:称取m g晶体、加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止、冷却、称量所得固体的质量为n g。
试评价上述两种实验方案,其中正确的方案是______,据此计算得x = ______________(用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是
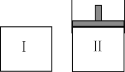
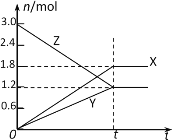
A.该反应的化学方程式为:3X+2Y![]() 2Z
2Z
B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D.若达平衡后,对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种天然除草剂的结构,下列说法正确的是
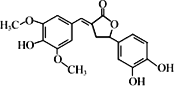
A.该除草剂可以和NaHCO3溶液发生反应
B.该除草剂分子中所有碳原子一定在同一平面内
C.1 mol该除草剂最多能与6 mol NaOH反应
D.该除草剂与足量的H2加成反应的产物含7个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随加水体积变化的曲线如图所示。下列说法正确的是
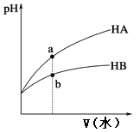
A. HB的酸性强于HA
B. a点溶液的导电性大于b点溶液
C. 同浓度的NaA与NaB溶液中,c(A-)=c(B-)
D. 加水稀释到pH相同时,酸HA、HB用到的水V(A)小于V(B)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com