



 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
| A、0.1 mol?L-1NaAlO2溶液:Al3+、Na+、Cl-、NO3- |
| B、加入金属铝产生H2的溶液中:NH4+、K+、SO42-、NO3- |
| C、含有大量ClO-的溶液中:K+、Na+、NO3-、SO42- |
| D、0.1mol/LFeCl3溶液中:Na+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg的摩尔质量为24g |
| B、物质的量的单位是摩尔 |
| C、1 mol O2在任何条件下的体积都为22.4L |
| D、将1 mol NaCl晶体加入到1L水中,得到NaCl溶液的浓度就是1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有关短周期元素A、B、C、D、E、F的信息如下:
有关短周期元素A、B、C、D、E、F的信息如下:| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | M层上有3个电子 |
| D | 短周期原子半径最大的主族元素 |
| E | 其单质是淡黄色固体 |
| F | 最高正价与最低负价代数和为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1,4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
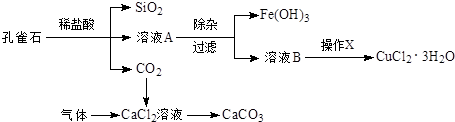
| 物质 | pH (开始沉淀) | pH(完全沉淀) |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓盐酸 | KMnO4 | AgNO3 | 说明氯气能与硝酸银反应产生白色沉淀 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中中心原子通过sp2杂化轨道成键时,该分子不一定为平面三角形结构 |
| B、杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子 |
| C、N2分子中N原子没有杂化,分子中有1个σ键、2个π键 |
| D、H2SO4分子中三种原子均以杂化轨道成键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com