
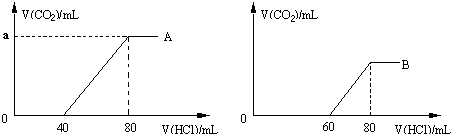
���� ��1����A������0-40mLû���������ɣ�������ӦNa2CO3+HCl=NaHCO3+NaCl��40-80mL���������ɣ�����NaHCO3+HCl=NaCl+H2O+CO2�������ݷ�Ӧ����ʽ���������
��B������0-60mLû���������ɣ�60-80mL���������ɣ�û�����巢���ķ�Ӧ����HCl�࣬���Ե�0��V��HCl����60ʱ������̼����������ķ�Ӧ������NaOH������ķ�Ӧ��
��2��A������0-40mLû���������ɣ�������ӦNa2CO3+HCl=NaHCO3+NaCl��40-80mL���������ɣ�����NaHCO3+HCl=NaCl+H2O+CO2������Naԭ���غ����NaOH�����ʵ�����Ũ�ȣ�B��Һ�м���ͨ������̼���������ȫ��ת��Ϊ̼�����ƣ���Ϸ����ķ�Ӧ���㣮
��� �⣺��1����A������0-40mLû���������ɣ�������ӦNa2CO3+HCl=NaHCO3+NaCl��40-80mL���������ɣ�����NaHCO3+HCl=NaCl+H2O+CO2�����������ĵ�����������ͬ���ɷ���ʽ�ļ�������֪����Һ�е�����ΪNa2CO3����40-80mLʱ����������ʵ���Ϊ0.1mol•L-1��0.04L=0.004mol���������ɵĶ�����̼Ϊ0.004mol�������Ϊ0.004mol��22.4L/mol=0.0896L=89.6mL��
�ʴ�Ϊ��Na2CO3��89.6��
��B������0-60mLû���������ɣ�60-80mL���������ɣ�û�����巢���ķ�Ӧ����HCl�࣬���Ե�0��V��HCl����60ʱ������̼����������ķ�Ӧ������NaOH������ķ�Ӧ����0��V��HCl����60ʱ�������ķ�Ӧ�ķ���ʽΪ��NaOH+HCl=NaCl+H2O��Na2CO3+HCl=NaHCO3+NaCl��
�ʴ�Ϊ��NaOH+HCl=NaCl+H2O��Na2CO3+HCl=NaHCO3+NaCl��
��2��A������0-40mLû���������ɣ�������ӦNa2CO3+HCl=NaHCO3+NaCl��40-80mL���������ɣ�����NaHCO3+HCl=NaCl+H2O+CO2����������Ӧ���ĵ�������ͬ����������Ӧһ�����ĵ�����Ϊn��HCl��=0.004mol��2=0.008mol����n��NaCl��=0.008mol����Naԭ���غ��֪n��NaOH��=0.008mol������c��NaOH��=$\frac{0.008mol}{0.05L}$=0.16mol/L��
0.008molNaOHȫ��ת��ΪNaHCO3��Ҫ������̼Ϊ0.008mol��B������60-80mL�����ɵĶ�����̼Ϊ0.1mol•L-1��0.02L=0.002mol������������ȫ��ת��Ϊ̼������
����Ҫͨ�������̼Ϊ0.008mol-0.002mol=0.006mol�������Ϊ0.006mol��22.4L/mol=0.1344L=134.4mL����
�ʴ�Ϊ��0.16��134.4mL��
���� ���⿼��������йؼ��㣬���ط��������������ͼ���뷴Ӧ��Ӧ��ϵ�ж������Ŀ��飬����ͼ�����������ķ�Ӧ�Ĺ�ϵ���������������ж�CO2��NaOH��Ӧ�����ǹؼ�����Ŀ�ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ý��ݹ����������Һ�Ĺ�������ˮ���ͷŵ���ϩ���ɴﵽˮ�����ʵ�Ŀ�� | |
| B�� | �ڽ����·�������Σ�����������ˮ������ѧ��Ӧ�ų�������������ʹ��ѩ�ڻ� | |
| C�� | ʳ������ζ������ҵ�ϳ��õ�ⱥ��ʳ��ˮ�Ʊ��������� | |
| D�� | ̫���ܵ�ذ��еĹ��Ƕ������裬���ά����Ҫ�ɷ��ǹ赥�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
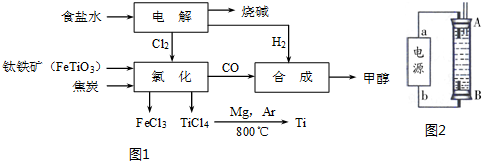
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H+ | B�� | K+ | C�� | Cl- | D�� | Ba2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��C3H8��g��+5O2��g��=3CO2��g��+4H2O��g������H=-2221.5 kJ•mol-1 | |
| B�� | ������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��2C4H10��g��+18O2��g��=8CO2��g��+10H2O��l������H=-2878 kJ•mol-1 | |
| C�� | ������ת��Ϊ�춡��Ĺ�����һ�����ȹ��� | |
| D�� | ��������춡���ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �ζ����� | �ζ�ǰ������mL�� | �ζ��������mL�� |
| 1 | 1.20 | 16.21 |
| 2 | 3.00 | 18.90 |
| 3 | 4.50 | 19.49 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
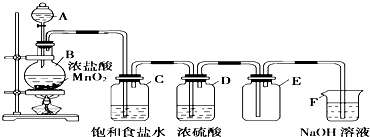
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com