
【题目】运用盖斯定律可计算一些不易测定的反应的反应热。
(1)已知在298K时下述反应的有关数据:C(s) +![]() O2(g)=CO(g) △H1=-110.5 kJ·mol-1,C(s) + O2(g)=CO2(g) △H2=-393.5 kJ·mol-1。则C(s) + CO2(g)=2CO(g) 的△H为__________________。
O2(g)=CO(g) △H1=-110.5 kJ·mol-1,C(s) + O2(g)=CO2(g) △H2=-393.5 kJ·mol-1。则C(s) + CO2(g)=2CO(g) 的△H为__________________。
(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。
已知:N2(g) + 2O2(g)=2NO2(g) △H=+67.7 kJ·mol-l;
N2H4(g) + O2(g)=N2(g) + 2H2O(g) △H=-534 kJ·mol-l。
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为___________________。
【答案】172.5 kJ·mol-1 2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g) △H=-1135.7 kJ ·mol-1
【解析】
(1)已知:①C(s) +![]() O2(g)=CO(g) △H1=-110.5 kJ·mol-1,
O2(g)=CO(g) △H1=-110.5 kJ·mol-1,
②C(s) + O2(g)=CO2(g) △H2=-393.5 kJ·mol-1;
利用盖斯定律,将①×2-②,可得 C(s)+CO2(g)═2CO(g),
则:△H=-110.5kJ/mol×2+393.5kJ/mol=+172.5 kJ/mol;
(2)已知:①N2(g) + 2O2(g)=2NO2(g) △H=+67.7 kJ·mol-l;
②N2H4(g) + O2(g)=N2(g) + 2H2O(g) △H=-534 kJ·mol-l;
由盖斯定律,②×2-①得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g),故该反应的△H=2×(-534kJmol-1)-67.7kJmol-1)=-1135.7 kJmol-1,
即2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJmol-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大________min(填“0~1”,“1~2”,“2~3”,“3~4”或“4~5”),原因是______________________________。
②求3~4min时间段以盐酸的浓度变化来表示的该反应速率________(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是________(填字母)。
A.蒸馏水 B.KCl溶液
C.KNO3溶液 D.Na2SO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
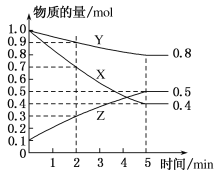
①该反应的化学方程式是_______________。
②该反应达到平衡状态的标志是________(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1molY的同时消耗2molZ
③2min内Y的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在含氯物质的制取、含量测定等方面有重要的作用。
⑴将一定量的氯气通入过量NaOH溶液中,由于副反应的存在,溶液中同时存在Cl-、ClO-和ClO3-。若Cl-、ClO-和ClO3-的物质的量分别为a mol、b mol和c mol,根据电子得失守恒可知a、b、c之间一定存在的等量关系是______。
⑵工业次氯酸钠溶液中含有氯酸钠会影响产品质量。测定次氯酸钠样品中的氯酸钠含量的过程如下:
步骤Ⅰ:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将ClO-完全还原成Cl-(ClO3-在该条件不与H2O2反应),加热煮沸,冷却至室温,加入硫酸至酸性,
步骤Ⅱ:向步骤Ⅰ所得溶液中加入0.1000 mol·L-1硫酸亚铁溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点,消耗该溶液20.00 mL。
已知步骤Ⅱ中涉及的相关反应转化为:ClO3-![]() Cl-,Cr2O72-
Cl-,Cr2O72-![]() Cr3+,则碱性NaClO溶液试样中所含NaClO3的物质的量浓度为______mol·L-1。
Cr3+,则碱性NaClO溶液试样中所含NaClO3的物质的量浓度为______mol·L-1。
⑶NaClO2广泛用于造纸工业、污水处理等,可由ClO2为原料反应制得。某溶液X中同时含有ClO2和NaClO2,为测定其中ClO2-的浓度,现进行如下实验:
步骤1:量取25.00 mL溶液X,调节溶液的pH为8.0,加入足量的KI晶体(发生反应:2ClO2+2I-=2ClO2-+I2)。滴入2滴淀粉溶液,滴加0.02000 mol·L-1Na2S2O3溶液(发生反应:2Na2S2O3+I2=Na2S4O6+2NaI)。恰好完全反应时,消耗Na2S2O3溶液12.50 mL。
步骤2:调节上述反应后溶液的pH为1.0(发生反应:ClO2-+4H++4I-=Cl-+2I2+2H2O),滴加0.2500 mol·L-1Na2S2O3溶液。恰好完全反应时,消耗Na2S2O3溶液40.00 mL。请计算溶液X中ClO2-的物质的量浓度(写出计算过程)。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O![]() ZnO+2MnO(OH)。下列说法正确的是( )
ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当65 g Zn完全溶解时,流经电极的电子为1mol
D.电池正极反应式为2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是
A. 稀硫酸与0.1 mol·L-1 NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l) ΔH=+57.3 kJ·mol-1
B. 在101 kPa下H2(g)的燃烧热为285.8 kJ·mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) ΔH=+285.8 kJ·mol-1
C. 已知CH3OH的燃烧热为726.8 kJ·mol-1,则有CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-726.8 kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-726.8 kJ·mol-1
D. 已知9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g FeS时放出19.12 kJ热量,则Fe(s)+S(s)=FeS(s) ΔH=-95.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
A.196.64 kJB.196.64 kJ/molC.<196.64 kJD.>196.64 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
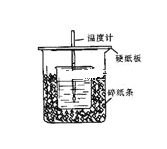
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___。
(2)烧杯间填满碎纸条的作用是___。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___(填“偏大、偏小、无影响”)。
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等、不相等”),所求中和热___(填“相等、不相等”)。
(5)用相同浓度和体积的氨水(NH3H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会___;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4A+2B![]() 3C,下列说法中正确的是
3C,下列说法中正确的是
A. 某温度时,化学反应速率无论用A. B. C中任何物质表示,其数值都相同
B. 其他条件不变时,降低温度,化学反应速率减小
C. 其他条件不变时,增大压强,化学反应速率一定加快
D. 若增大或减小A的物质的量,化学反应速率一定会发生明显的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,X、Y、Z、W为短周期主族元素,W的原子序数是Z的2倍。下列说法中正确的是
X | Y | Z | ||
W |
A.简单离子半径:Y<Z
B.Y元素的最高价氧化物对应的水化物在一定条件下可以和X单质反应
C.氢化物的沸点:X<Z
D.WZ2具有漂白性,其漂白原理与双氧水相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com