
【题目】《化学与生活》
(1)材料是人类赖以生存的物质基础
①制造水泥、玻璃都要用到的原料是___________(填字母)
A.石灰石 B.纯碱 C.黏土
②不锈钢丝与棉纤维可织成一种防辐射布料,这种布料属于___________(填字母)
A.合金材料 B.复合材料 C.陶瓷材料
③SiC是一种新型的陶瓷.工业上用石英砂与焦炭在高温条件下生成SiC,同时生成
CO,该制备反应的化学方程式为 。
(2)保证食品安全、合理使用药物是人体健康的基础。
①营养平衡、科学使用食品添加剂有助于健康和提高免疫力。下列物质常用作食品防腐剂的是________ (填字母)
A.苯甲酸纳 B.味精 C.柠檬黄
②下列药物厲于国际奥委会严格禁止的兴奋剂是_______(填字母)
A.阿司匹林 B.青霉素 C.吗啡
③氨基酸分子中含有的官能团是氨基和___________(写名称)。人体中共有20多种氨基酸,其中人体自身——(填“能”或“不能”)合成的氨基酸称为人体必须氨基酸.
④在一支盛有2 mL 2%淀粉溶液的试管中滴入2滴碘水,溶液呈_____________色,再滴入维生素C的水溶液,溶液颜色褪去,该实验说明维生素C具有________________(填“酸”、“氧化”、或“还原”)性。
(3)防治环境污染,改善生态环境己成为全球的共识。
①下列措施不利于改善环境质量的是_______________(填字母)
A.利用太阳能发电,以获取清洁能源
B.将废电池深埋土壤中,以减少污染
C.合成聚碳酸酯类可降解塑料代替聚乙烯
②向煤中加入石灰石作为脱硫剂,可以减少SO2的排放,生成CaSO4。写出SO2转化为CaSO4的化学方程式________________________________________。
③天然水中含有的细小悬浮颗粒可以用明矾等作为混凝剂进行净化处理,该混凝剂的净水原理用离子方程式表示为_______________________。
【答案】⑴①a(1分)②b(1分)③SiO2+3C![]() SiC+2CO↑(2分)
SiC+2CO↑(2分)
(2)①a(1分〉②c(1分)③羧基(1分)不能(1分)④蓝(1分)还原(1分)
(3)①b(1分)②2CaCO3+2SO2+O2=2CaSO4+2CO2(2分)或写成分步反应
③A13++3H2O![]() Al(OH)3(胶体)+3H+(2分)
Al(OH)3(胶体)+3H+(2分)
【解析】
试题分析:(1)① 制造水泥需要石灰石和黏土,玻璃需要石灰石、纯碱和石英,因此都要用到的原料是石灰石,答案选a;
②不锈钢丝与棉纤维可织成一种防辐射布料,这种布料属于复合材料,答案选b;
③石英砂与焦炭在高温条件下生成SiC,同时生成CO,因此该制备反应的化学方程式为 SiO2 + 3C![]() SiC + 2CO↑。
SiC + 2CO↑。
(2)①A.苯甲酸钠常用作防腐剂;B.味精常用作调味剂;C.柠檬黄常用作防腐剂,答案选b;
②阿司匹林、青霉素不属于兴奋剂,吗啡属于严格禁止的兴奋剂,答案选c;
③氨基酸分子中含有的官能团是氨基和羧基。人体中共有20多种氨基酸,其中人体自身不能合成的氨基酸称为人体必须氨基酸;
④在一支盛有2 mL 2%淀粉溶液的试管中滴入2滴碘水,溶液呈蓝色,再滴入维生素C的水溶液,溶液颜色褪去,说明碘被还原,因此该实验说明维生素C具有还原性。
(3)①A.利用太阳能发电,以获取清洁能源有利于改善环境,a正确;B.将废电池深埋土壤中,容易造成重金属污染,b错误C.合成聚碳酸酯类可降解塑料代替聚乙烯有利于减少白色污染,c正确。答案选b;
②SO2转化为CaSO4的化学方程式为2CaCO3 +2SO2 +O2 = 2CaSO4 +2CO2。
③明矾溶于水电离出的铝离子水解生成氢氧化铝胶体而检验吸附性,因此可以作净水剂,反应离子方程式表示为A13++3H2O![]() Al(OH)3(胶体)+3H+。
Al(OH)3(胶体)+3H+。


科目:高中化学 来源: 题型:
【题目】将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
(1)简要阐述上述产生混合气体的理由(用化学方程式回答)?
(2)NO、NO2的体积各为多少升?
(3)待产生的气体全部释放后,向溶液加入250 mL 5 mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应CaCO3(s) = CaO (s)+CO2(g),下列说法中正确的是( )
A.△H < 0 B.△S < 0 C.高温下自发进行 D.一定不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应
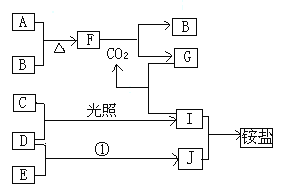
请回答下列问题:
(1)分別写出E、F的电子式:E________,F___________;
(2)实验室制J的化学方程式____________________________。
(3)由F制取B的反应中,每产生标准状况下11.2L的B,转移电子的物质的量为__________;
(4)在C、D、E.、I、J分子中,以极性键结合的是___________________ (填相应的字母,下同),以非极性键结合的是___________;
(5)用电子式表示I的形成过程__________________;
(6)现将标准状况下1.12 L二氧化碳通入60 mL 1 mol/L的A的最高价氧化物对应的水化物溶液中,则反应后溶液中溶质的物质的量之比为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.应用铝热反应能焊接钢轨 B.比色法可以测定化学反应速率
C.工业制硝酸需要热交换器 D.反应热均可通过实验直接测定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上通过高温分解FeSO4的方法制备Fe2O3,化学方程式为:2FeSO4 ![]() Fe2O3+ SO3↑ + SO2↑为检验FeSO4高温分解的产物,进行如下实验:
Fe2O3+ SO3↑ + SO2↑为检验FeSO4高温分解的产物,进行如下实验:
检验FeSO4高温分解产生的气体,将FeSO4高温分解产生的气体通入下图装置中。

① 装置A试管可选用的试剂是_________(填标号)。
a. 水 b. BaCl2溶液 c. Ba(NO3)2溶液 d. Ba(OH)2溶液
② 装置C的作用是防止尾气污染环境,试管中应加入的试剂是_________________。
③ 若装置B试管中溶液改为酸性KMnO4溶液,可以观察到溶液紫色褪去,反应的离子方程式为__________________________ 。
(2)工业上在一定温度和催化剂条件下用NH3将NO2还原生成N2,某同学在实验室中对NH3与NO2反应进行了探究。

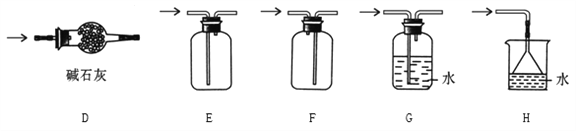
①实验室可以用A、B或C装置制取氨气,如果用C装置,则该装置中烧瓶所盛放的试剂为________(写名称);反应的化学方程式是_____________________;
② 预收集一瓶干燥的氨气,选择下图中的装置,其气体收集和尾气处理装置连接顺序依次为:发生装置→_____________________(用字母表示)
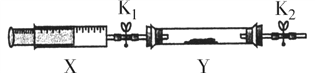
③ 将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按下图装置进行实验。打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中,Y管观察到的实验现象是____________________ ,反应的化学方程式为 ______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量的Cu2O和CuO混合粉末,将其均匀混合后分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为
A. 3.6mol/L B. 3.2mol/L C. 2.8mol/L D. 2.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】称取两份铝粉,第一份加足量NaOH溶液,第二份加足量硫酸,如果要得到相同体积(同温同压)的氢气,两份铝粉的质量比是( )
A.1:1
B.1:3
C.3:2
D.1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓盐酸和Ca(ClO)2能发生如下反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2十2H20用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是( )
A.CO2、HC1、H2O B.HC1、H2O、O2
C.HC1、H2O D.CO2、O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com