
| A. | 用100mL量筒量取5.2mL稀硫酸 | |
| B. | 用碱式滴定管量取20.10mLCCl4 | |
| C. | 用托盘天平称取8.56g食盐 | |
| D. | 用酸式滴定管量取20.50mLKMnO4溶液 |
分析 A.100mL量筒精确到1ml;
B.根据CCl4能腐蚀碱式滴定管中的橡皮;
C.根据托盘天平的精确到的最小值来判断;
D.滴定管精确到0.01.
解答 解:A.量取5.2mL的稀硫酸,选用100mL量筒误差大,应选用10mL量筒,故A错误;
B.CCl4能腐蚀碱式滴定管中的橡皮,所以只能用酸式滴定管量取20.10mLCCl4,故B错误;
C.托盘天平能准确到0.1g,用托盘天平不能称取8.56g食盐,故C错误;
D.滴定管精确到0.01,可用酸式滴定管量取20.50mLKMnO4溶液,故D正确;
故选D.
点评 本题考查化学实验的基本操作,题目难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化亚铜和硝酸反应:3Cu2O+14HNO3(稀)═6Cu(NO3)2+2NO+7H20,属于氧化还原反应 | |
| B. | Cl2+SO2+2H2O═H2SO4+2HCl属于氧化还原反应 | |
| C. | 4Fe(OH)2+O2+2H2O═4Fe(OH)2属于氧化还原反应和化合反应 | |
| D. | 金属单质与盐溶液的反应都是置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL 0.5 mol•L-1MgCl2溶液 | B. | 200mL 1.5 mol•L-1CaCl2溶液 | ||
| C. | 50mL 1 mol•L-1NaCl溶液 | D. | 25mL 0.5 mol•L-1vHCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
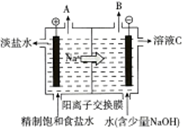 电解饱和食盐水的原理如图所示.
电解饱和食盐水的原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当它们等物质的量时,质量比就为11:7 | |
| B. | 当它们等质量时,碳原子个数比为1:1 | |
| C. | 当它们同温同压同质量时,体积之比为7:11 | |
| D. | 当它们同温同压同体积时,电子总数之比为7:11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com