
| | 实验事实 |
| 事实一 | 水蒸汽在600℃时可使粉末状硅缓慢氧化并放出氢气。 |
| 事实二 | 盛放于铂或石英器皿中的纯水长时间对粉末状还原硅无腐蚀作用。 |
| 事实三 | 普通玻璃器皿中的水仅因含有从玻璃中溶出的微量的碱便可使粉末状硅在其中缓慢溶解。 |
| 事实四 | 在野外环境里,用较高百分比的硅铁粉与干燥的Ca(OH)2和NaOH,点着后焖烧,可剧烈放出H2。 |
| 事实五 | 1g(0.036mo1)Si和20mL含有lgNaOH(0.025mol)的溶液,小心加热(稍微预热),收集到约1700mL H2,很接近理论值(1600mL)。 |


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源:不详 题型:填空题
| A.石英与普通玻璃都是硅酸盐制品 |
| B.二氧化硅是良好的半导体材料 |
| C.工艺师用盐酸刻蚀石英制作艺术品 |
| D.石英与二氧化碳中的化学键相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④⑥ | B.全部 | C.⑤⑦ | D.①②⑥⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水玻璃可用作木材防火剂 | B.硅是制造光导纤维的材料 |
| C.硅是制造太阳能电池的常用材料 | D.硅是构成一些岩石和矿物的基本元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2CO3比H2SiO3受热易分解 |
B.高温下能发生反应Na2CO3+SiO2 Na2SiO3+CO2↑ Na2SiO3+CO2↑ |
| C.CO2能溶于水生成碳酸,而SiO2却不溶于水 |
| D.CO2通入Na2SiO3溶液中有胶状沉淀生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。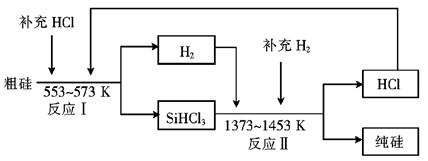
 SiHCl3+H2,
SiHCl3+H2,查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CO2溶于水形成碳酸,SiO2难溶于水 |
| B.CO2通入可溶性硅酸盐中析出硅酸沉淀 |
| C.高温下SiO2与碳酸盐反应生成CO2 |
| D.氯化氢通入碳酸钠溶液中放出气体,通入硅酸钠溶液中生成沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.处理宇航员的生活垃圾 | B.去除呼吸废气中的异味 |
| C.提供生活中需要的能量 | D.改善失重条件下的平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com