
分析 (1)电解质是在溶液中或熔融状态下能导电的化合物,酸、碱、氧属于电解质;
(2)含有氢原子数目相等,则H原子物质的量相等,根据n=$\frac{m}{M}$计算硫酸物质的量,再结合化学式计算氨气物质的量,根据V=nVm计算氨气体积;
(3)碘单质具有升华性质,利用加热方法除去.
解答 解:(1)①NH3 属于共价化合物,液态不导电,容易水导电是由于生成一水合氨电离得到,属于非电解质;②CaCO3 属于电解质;③酒精属于非电解质;④饱和食盐水为混合物,既不是电解质也不是非电解质;⑤Cu为单质,既不是电解质也不是非电解质;⑥KOH 属于电解质;⑦HCl属于电解质,
故答案为:②⑥⑦;
(2)硫酸物质的量为$\frac{14.7g}{98g/mol}$=0.15mol,与之含有相等氢原子数目的氨气为$\frac{0.15mol×2}{3}$=0.1mol,标况下氨气的体积为0.1mol×22.4L/mol=2.24L,
故答案为:2.24;
(3)碘单质具有升华性质,利用加热方法除去固体NaCl中混有的I2,
故答案为:加热.
点评 本题考查电解质与非电解质、物质的量计算、物质的分离提纯,比较基础,注意对电解质与非电解质概念的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | A,B分别为0.4mol•L-1,0.2mol•L-1 | B. | A为0.25mol•L-1 | ||
| C. | A,C均为0.15mol•L-1 | D. | A为0.24mol•L-1,C为0.14mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
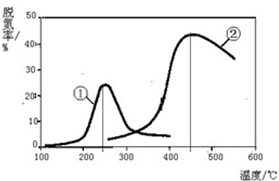 进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.时间/min 温度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②③ | C. | ③④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
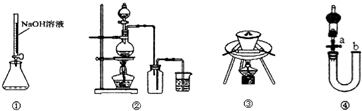
| A. | 用装置①量取15.00mL的NaOH溶液 | |
| B. | 用装置②制备并收集Cl2 | |
| C. | 用装置③陶瓷坩埚高温煅烧CaCO3固体 | |
| D. | 关闭活塞a,从b处加水,以检查装置④的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体、BaSO4 | B. | 铜、二氧化硫 | ||
| C. | NaOH固体、CO2 | D. | 熔融的KNO3、硫酸溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com