
| n |
| v |
| n |
| v |


科目:高中化学 来源: 题型:
| A、重水是原子反应堆的导热剂 |
| B、氘(D)原子核内有1个中子 |
| C、H2O与D2O的物理性质不相同 |
| D、1H、D与16O、18O形成的水分子,其相对分子质量不相同的有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
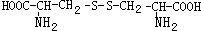
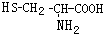 ,则下列说法错误的是
,则下列说法错误的是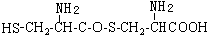
 可与NaOH溶液反应放出一种碱性气体.
可与NaOH溶液反应放出一种碱性气体.查看答案和解析>>
科目:高中化学 来源: 题型:
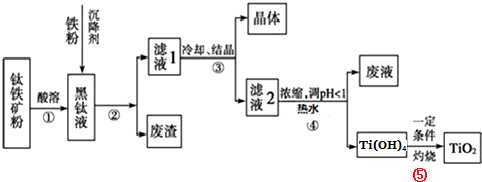
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有可逆反应:mA(g)+nB(g)?pC(g)+qD(g);根据如图示回答:
现有可逆反应:mA(g)+nB(g)?pC(g)+qD(g);根据如图示回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、15.6gNa2O2与过量CO2反应时,转移的电子数为0.2NA |
| B、0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.02NA |
| C、7.1gCl2与足量Ca(OH)2反应时转移的电子总数为0.2NA |
| D、1.7gNH3中含有的质子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com