

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.4 | 8.0 |
分析 (1)印刷电路板加入氯化铁溶液溶解铜,溶液中加入氧化剂氧化亚铁离子为铁离子,溶液中再加入氧化铜或氢氧化铜等调节溶液PH使铁离子全部沉淀,过滤得到滤液通过浓缩蒸发结晶析出,过滤洗涤得到氯化铜晶体,氯化氢气流中加热失去结晶水得到氯化铜固体;
①分析流程可知,步骤Ⅲ是过滤;
②加入试剂a能溶解铜,制备氯化铜,不能引入新的杂质;
③若不加入试剂b,溶液中亚铁离子不能除去,制备的氯化铜含有杂质;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(3)依据化学反应方程式,正极上是元素化合价降低,得到电子发生还原反应;
(4)用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,依据化学反应的定量关系计算得到.
解答 解:(1)印刷电路板加入氯化铁溶液溶解铜,溶液中加入氧化剂氧化亚铁离子为铁离子,溶液中再加入氧化铜或氢氧化铜等调节溶液PH使铁离子全部沉淀,过滤得到滤液通过浓缩蒸发结晶析出,过滤洗涤得到氯化铜晶体,氯化氢气流中加热失去结晶水得到氯化铜固体;
①分析流程可知,步骤Ⅲ是分离固体和溶液,用过滤操作,故答案为:过滤;
②加入试剂a能溶解铜,制备氯化铜,不能引入新的杂质;
A.HNO3溶液能溶解铜氧化亚铁离子,但引入硝酸根离子,故A错误;
B.Fe2(SO4)3溶液可以溶解铜,但会引入硫酸根离子,故B错误;
C.FeCl3溶液溶解铜,不引入新的杂质,故C正确;
故答案为:C;
③若不加入试剂b,溶液中亚铁离子不能除去,制备的氯化铜含有杂质,影响所得CuCl2纯度;
故答案为:否;不能除去Fe2+,影响所得CuCl2纯度;
(2)已知:①2H2O2(l)=2H2O (l)+O2(g)△H1=-196kJ/mol
②H2O(l)=H2(g)+1/2O2(g)△H2=+286kJ/mol
③Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)△H3=+64kJ/mol
由盖斯定律①÷$\frac{1}{2}$-②+③得到:Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l)△H=-320KJ/mol,
故答案为:-320KJ/mol;
(3)正极上是元素化合价降低,得到电子发生还原反应,将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,是过氧化氢得到电子发生还原反应,其正极电极反应式是:H2O2+2H++2e-=2H2O,
故答案为:H2O2+2H++2e-=2H2O;
(4)用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,反应的化学方程式为3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O,欲制取3mol纯净的硫酸铜,依据化学方程式可知得到需要硝酸2mol,需要0.5mol/L的硝酸溶液的体积=$\frac{2mol}{0.5mol/L}$=4L,故答案为:4.
点评 本题考查了物质分离提纯流程的方法分析判断,试剂选择,热化学方程式书写,原电池原理的理解应用,注意化学方程式定量计算,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
| 物质 | A | NaCl | KCl | CaCl2 |
| 熔点(K) | 1074 | 918 | ||
| 物质 | B | Na | Mg | Al |
| 熔点(K) | 317 | 923 | 933 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:HCl>HBr>HI | B. | 离子半径:S2->Na+>O2- | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 熔点:SiO2>NaCl>干冰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
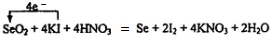 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 蘸有浓氨水的玻璃棒靠近某溶液 | 有白烟产生 | 该溶液可能是浓盐酸 |
| B | 将SO2通入Ba(NO3)2溶液 | 产生白色沉淀 | SO2与可溶性钡盐均可生成白色沉淀 |
| C | 向Zn与稀硫酸反应的溶液中滴加硫酸铜溶液 | 产生气体的速率加快 | 硫酸铜作该反应的催化剂 |
| D | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
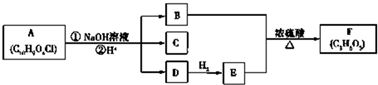
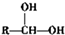 $\stackrel{自动脱水}{→}$
$\stackrel{自动脱水}{→}$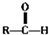 (R为羟基)
(R为羟基) .
. .
.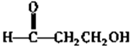 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
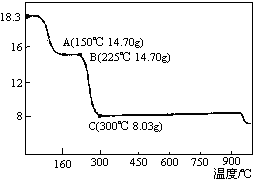 草酸钴是制备钴的氧化物的重要原料.如图为二水合草酸钴(CoC2O4•2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物.
草酸钴是制备钴的氧化物的重要原料.如图为二水合草酸钴(CoC2O4•2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | 钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用 | |
| C. | 积极开发新能源,如可燃冰、生物汽油等,减少对化石燃料的依赖 | |
| D. | 随着化学的发展,化学实验方法并不是化学研究的唯一手段 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com