
分析 给出八种离子,形成四种可溶性物质,这个可以通过一一组合的形式确定可能存在的物质,之后结合进行实验和颜色限制进行继续排除,从而最终确定.如Ba2+不能和SO42-、CO32-结合,而只能和NO3-、Cl-;Ag+不能和SO42-、Cl-、CO32-三种离子结合,而只能和NO3-结合,则一定是BaCl2、AgNO3.Cu2+不能和CO32-结合,所以为CuSO4;Na+对应CO32-为Na2CO3.即四种物质为BaCl2、AgNO3、CuSO4、Na2CO3.
①中由于C盐是蓝色的,所以C为CuSO4;
②四支试管加入盐酸,B有沉淀,则B溶液为AgNO3;而D生成无色气体,则为二氧化碳,即D为Na2CO3,以此来解答.
解答 解:由于是可溶性盐,所以溶液中存在的盐离子和阴离子对应物质一定是可溶性,根据盐类物质溶解性情况可知:Ba2+不能和SO42-、CO32-结合,而只能和NO3-、Cl-;Ag+不能和SO42-、Cl-、CO32-三种离子结合,而只能和NO3-结合,则一定是BaCl2、AgNO3.Cu2+不能和CO32-结合,所以为CuSO4,Na+对应CO32-为Na2CO3.即四种物质为BaCl2、AgNO3、CuSO4、Na2CO3.
①中由于C盐是蓝色的,所以C为CuSO4;
②四支试管加入盐酸,B有沉淀,则B溶液为AgNO3;而D生成无色气体,则为二氧化碳,即D为Na2CO3.
综上所述:A为BaCl2;B为AgNO3;C为CuSO4;D为Na2CO3;
(1)由上述分析可知A为BaCl2;B为AgNO3;故答案为:BaCl2;AgNO3;
(2)盐酸与D(Na2CO3)反应的离子反应方程式为:CO32-+2H+=CO2↑+H2O,故答案为:CO32-+2H+=CO2↑+H2O;
(3)A为BaCl2;B为AgNO3;C为CuSO4,将含相同物质的量A、B、C的溶液混合后,溶液中存在的离子及物质的量之比为:n(Cl-):n(NO3-):n(Cu2+)=1:1:1,在此溶液中加入锌粒,可以将其中的铜置换出来,发生反应的离子方程式Zn+Cu2+═Fe2++Cu,故答案为:n(Cl-):n(NO3-):n(Cu2+)=1:1:1;Zn+Cu2+═Fe2++Cu.
点评 本题考查无机物的推断,为高频考点,把握离子之间的反应、离子的颜色为解答的关键,注意C为硫酸铜为推断的突破口,侧重分析、推断能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ② | C. | ①② | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
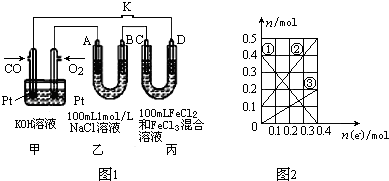
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | ||||
| CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||||
| 1 | 500 | 2 | 4 | 0 | 1 | ||
| 2 | 500 | 1.4 | 2.8 | 0.6 | a | ||
| 3 | 750 | 0 | 0 | 2 | 0.8 | ||
| 4 | 750 | 0.8 | 1.6 | 1.2 | b | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Na+、Fe3+、NO3-、OH- | |
| B. | 滴加酚酞溶液呈红色:K+、NO3-、H+、HCO3- | |
| C. | 0.1 mol•L-1 CaCl2的溶液中:Na+、K+、CO32-、SO42- | |
| D. | 能与Mg反应生成H2的溶液:Na+、K+、SO42-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯使溴的四氯化碳溶液褪色 | |
| C. | 甲烷与氯气混合光照一段时间后黄绿色褪色 | |
| D. | 乙烯在催化剂作用下生成聚乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com