
【题目】羟基自由基(·OH,电中性,O为-1价)是一种活性含氧微粒。常温下,利用·OH处理含苯酚废水,可将其转化为无毒的氧化物。
(1)·OH的电子式为________。
(2) pH=3时Fe2+催化H2O2的分解过程中产生·OH中间体,催化循环反应如下。将ii补充完整。
i.Fe2++ H2O2+H+ === Fe3++ H2O +·OH
ii.___ + ___ === ___ + O2↑+2H+
(3)已知:羟基自由基容易发生猝灭2·OH === H2O2。用H2O2分解产生的·OH脱除苯酚,当其他条件不变时,不同温度下,苯酚的浓度随时间的变化如下图所示。0~20 min时,温度从40℃上升到50℃,反应速率基本不变的原因是________。


(4)利用电化学高级氧化技术可以在电解槽中持续产生·OH,使处理含苯酚废水更加高效,装置如上图所示。已知a极主要发生的反应是O2生成H2O2,然后在电解液中产生·OH并迅速与苯酚反应。
① b极连接电源的________极(填“正”或“负”)。
②a极的电极反应式为________。
③电解液中发生的主要反应方程式为________。
【答案】![]() 2 Fe3+ 2·OH- 2Fe2+ 从图1可知,0~20 min,40~50℃,升高温度化学反应速率应该加快但是50℃时,温度升高羟基自由基发生猝灭(或温度升高过氧化氢分解产生氧气),导致c(·OH)下降(1分),所以,温度从40℃上升到50℃,反应速率不基本不变。 正 Fe2++ H2O2+H+ === Fe3++ H2O +·OH C6H6O + 28·OH-===6CO2 + 17H2O
2 Fe3+ 2·OH- 2Fe2+ 从图1可知,0~20 min,40~50℃,升高温度化学反应速率应该加快但是50℃时,温度升高羟基自由基发生猝灭(或温度升高过氧化氢分解产生氧气),导致c(·OH)下降(1分),所以,温度从40℃上升到50℃,反应速率不基本不变。 正 Fe2++ H2O2+H+ === Fe3++ H2O +·OH C6H6O + 28·OH-===6CO2 + 17H2O
【解析】
(1)本小题考查的是电子式的书写,羟基自由基(·OH)中氧原子最外层有6个电子,达到8电子稳定结构需得2个电子,拿出一个电子与氢原子的一个电子形成一对共用电子对,即形成一个共价键,还剩余一个电子,则羟基自由基的电子式为![]() 。
。
(2)催化剂在反应前后质量不变相当于没有参与反应。根据总反应减去一个反应得到另一个反应。2H2O2=2H2O+O2↑为反应 i和ii的总反应,总反应减去反应i即得到反应ii。
(3)本小题考查的是影响速率的因素。升高温度化学反应速率应该加快,但是50℃时,温度升高羟基自由基发生猝灭,导致c(·OH)下降,反应速率基本不变。
(4)①根据反应类型判断阴阳极,得电子发生还原反应的一极为电解池的阴极,与电源的负极相连,失电子发生氧化反应的一极为电解池的阳极,与电源的正极相连。
②b极是Fe电极为活性电极,电极反应式为Fe-2e-=Fe2+,产生的Fe2+向阴极移动;由题意可知a极主要发生的反应是O2生成H2O2,电极反应为O2+2e-+2H+=H2O2,然后在电解液中产生·OH,故a极的电极反应式为Fe2++ H2O2+H+ === Fe3++ H2O +·OH。
③由题意可知a极主要发生的反应是O2生成H2O2,然后在电解液中产生·OH,·OH能迅速与苯酚反应,则电解液中发生的主要反应方程式为C6H6O + 28·OH-===6CO2 + 17H2O。
(1)羟基自由基(·OH)中氧原子最外层有6个电子,达到8电子稳定结构需得2个电子,拿出一个电子与氢原子的一个电子形成一对共用电子对,即形成一个共价键,还剩余一个电子,则羟基自由基的电子式为![]() 。本小题答案为:
。本小题答案为:![]() 。
。
(2)由题意可知Fe2+为H2O2的分解反应的催化剂,则 i和ii反应合并的总反应为2H2O2=2H2O+O2↑,若反应i为Fe2++ H2O2+H+ === Fe3++ H2O +·OH则反应ii 为2 Fe3+ + 2·OH- === 2Fe2++ O2↑+2H+。本小题答案为:2 Fe3+ ;2·OH- ;2Fe2+。
(3)从图1可知,0~20 min,40~50℃,升高温度化学反应速率应该加快,但是50℃时,温度升高羟基自由基发生猝灭(或温度升高过氧化氢分解产生氧气),导致c(·OH)下降,所以,温度从40℃上升到50℃,反应速率基本不变。本小题答案为:从图1可知,0~20 min,40~50℃,升高温度化学反应速率应该加快但是50℃时,温度升高羟基自由基发生猝灭(或温度升高过氧化氢分解产生氧气),导致c(·OH)下降,所以,温度从40℃上升到50℃,反应速率基本不变。
(4)①根据题意可知a极主要发生的反应是O2生成H2O2,氧气中的氧元素得电子由0价降低到-1价,发生还原反应,则a极为阴极,b极为阳极,故b极连接电源的正极。本小题答案为:正。
②b极是Fe电极为活性电极,电极反应式为Fe-2e-=Fe2+,产生的Fe2+向阴极移动;由题意可知a极主要发生的反应是O2生成H2O2,电极反应为O2+2e-+2H+=H2O2,然后在电解液中产生·OH,故a极的电极反应式为Fe2++ H2O2+H+ === Fe3++ H2O +·OH。本小题答案为:Fe2++ H2O2+H+ === Fe3++ H2O +·OH。
③由题意可知a极主要发生的反应是O2生成H2O2,然后在电解液中产生·OH,·OH能迅速与苯酚反应,则电解液中发生的主要反应方程式为C6H6O + 28·OH-===6CO2 + 17H2O。本小题答案为:C6H6O + 28·OH-===6CO2 + 17H2O。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,E2D2可用于呼吸面具或潜水艇中氧气的来源。请根据以上信息回答下列问题:
(1)BD2的电子式为_______________________。
(2)EAB2D4水溶液显酸性的原因是____________________________________。
(3)将等浓度等体积的EBC溶液和ABC溶液混合,所得混合溶液(呈碱性)中各微粒(水分子除外)浓度由大到小的顺序为_________________________________________。
(4)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出该化合物的溶液与足量的Ba(OH)2溶液反应的离子方程式__________________________________。
(5)常温下,测得X和Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是_________。
(6)在一个装有可移动活塞的密闭容器中进行如下可逆反应:C2(g)+3A2(g)![]() 2CA3(g)△H=-92.4 kJ/mol。反应达到平衡后,测得容器中各物质的物质的量分别为C2:0.5 mol、A2:0.2 mol、CA3:0.2 mol,此时容器体积为1.0 L。如果保持温度和压强不变,向上述平衡体系中加入0.18 molC2,平衡将______移动(填“正向”、“逆向”或“不”)。
2CA3(g)△H=-92.4 kJ/mol。反应达到平衡后,测得容器中各物质的物质的量分别为C2:0.5 mol、A2:0.2 mol、CA3:0.2 mol,此时容器体积为1.0 L。如果保持温度和压强不变,向上述平衡体系中加入0.18 molC2,平衡将______移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应 CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A. 反应 CO2(g)+C(s)![]() 2CO(g)的 ΔS>0、ΔH<0
2CO(g)的 ΔS>0、ΔH<0
B. 体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C. 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D. 逆反应速率v逆::v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,某反应达平衡时平衡常数K=c(C)·c(D)/c(A)·c(B)。恒容时,温度升高,C的物质的量浓度减小。下列说法正确的是( )
A. 该反应的焓变ΔH>0
B. 恒温恒容时,增大体系压强,c(D)一定增大
C. 升高温度,逆反应速率减小
D. 该反应的化学方程式可能为A(g)+B(g)![]() C(g)+D(g)
C(g)+D(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12。如图是向10mLAgNO3溶液中逐渐加入0.1mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论不正确的是( )[提示:Ksp(AgCl)>Ksp(AgI)]

A. 原AgNO3溶液的物质的量浓度为1mol·L-1
B. 图中x点的坐标为(100,6)
C. 图中x点表示溶液中AgNO3与NaCl恰好完全反应
D. 把0.1mol·L-1的NaCl换成0.1mol·L-1NaI则图像在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室需要 1.0 mol/L 的碳酸钠溶液 450 mL,利用碳酸钠晶体(Na2CO3·10H2O)来配制。下列说法正确的是
A. 应称取该碳酸钠晶体128.7 g
B. 取 100 mL 该溶液,向其中加入100 mL 水,所得溶液浓度为0.5 mol/L
C. 定容时俯视刻度线会引起配制溶液的浓度偏高
D. 定容、摇匀、静置后发现液面低于刻度线,应再补加少量水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向l0mL0.1mol/L的HR溶液中逐渐滴入0.lmol/L的NH3·H2O 溶液,所得溶液pH及导电性变化如图。下列分析不正确的是

A. ab点导电能力增强,说明HR为弱酸
B. b点溶液,c(NH3H2O)=c(R-)+c(H+)-c(OH-)
C. c点溶液,存在c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 常温下,HR和NH3H2O的电离平衡常数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X,Y,Z,W在周期表中的相对位置如下图所示, 已知它们的最外层电子数之和为18,下列说法正确的是
![]()
A. X,Y,Z,W中可能都是非金属元素
B. Z的最高价氧化物的水化物一定是强酸
C. 元素的最高化合价:W>Z>Y
D. 原子半径由大到小的顺序:W>Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,Fe、HCN与K2CO3可发生反应Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O。请回答下列问题:
(1)金属铁的堆积方式为___________,其配位数为___________。
(2)HCN分子的结构式为___________,写出一种与CN-互为等电子体的阴离子:___________。
(3)键角NH3___________(填“>”“<”或“=")NF3,原因是___________。
(4)K4Fe(CN)6的中心离子的核外电子排布式为___________。
(5)C、N、O、H的第一电离能由小到大的顺序为___________。
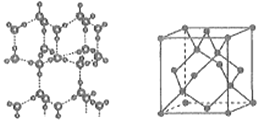
(6)冰的晶体结构模型如图所示,其晶胞结构(如图所示)与金刚石的晶胞结构相似,水分子间以氢键相连,则一个晶胞中含有___________个氢键,用NA表示阿伏加德罗常数的值,若氢键的键长为dnm,则晶体密度ρ=___________g·cm-3(用含有d、NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com