
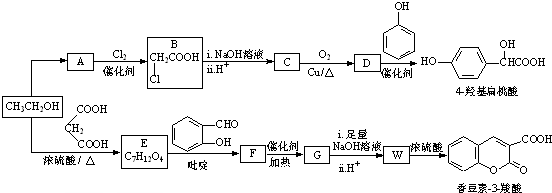
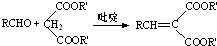 (R,R′,R″表示氢、烷基或芳基)
(R,R′,R″表示氢、烷基或芳基)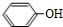 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$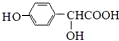 .
.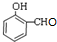 $\stackrel{吡啶}{→}$
$\stackrel{吡啶}{→}$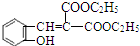 +H2O.
+H2O.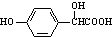 )的同分异构体
)的同分异构体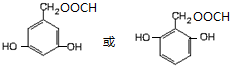 .
.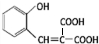 $\stackrel{浓硫酸}{→}$
$\stackrel{浓硫酸}{→}$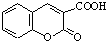 +H2O.
+H2O. 分析 乙醇与丙二酸发生酯化反应生成E,结合E的分子式可知,E的结构简式为C2H5OOC-CH2-COOC2H5,E与 发生信息Ⅱ中反应生成F,F系列反应得到香豆素-3-羧酸,由香豆素-3-羧酸的结构,可知W为
发生信息Ⅱ中反应生成F,F系列反应得到香豆素-3-羧酸,由香豆素-3-羧酸的结构,可知W为 ,则F为
,则F为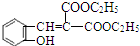 ,F发生信息I中反应生成G,C分子中含有2个六元环,则G为
,F发生信息I中反应生成G,C分子中含有2个六元环,则G为 .A的相对分子质量为60,由ClCH2COOH结构可知乙醇发生氧化反应生成A为CH3COOH,ClCH2COOH与氢氧化钠溶液反应、酸化得到C为HOCH2COOH,C发生催化氧化得到D为OHC-COOH,D与苯酚发生加成反应生成对羟基扁桃酸为
.A的相对分子质量为60,由ClCH2COOH结构可知乙醇发生氧化反应生成A为CH3COOH,ClCH2COOH与氢氧化钠溶液反应、酸化得到C为HOCH2COOH,C发生催化氧化得到D为OHC-COOH,D与苯酚发生加成反应生成对羟基扁桃酸为 ,据此解答.
,据此解答.
解答 解:乙醇与丙二酸发生酯化反应生成E,结合E的分子式可知,E的结构简式为C2H5OOC-CH2-COOC2H5,E与 发生信息Ⅱ中反应生成F,F系列反应得到香豆素-3-羧酸,由香豆素-3-羧酸的结构,可知W为
发生信息Ⅱ中反应生成F,F系列反应得到香豆素-3-羧酸,由香豆素-3-羧酸的结构,可知W为 ,则F为
,则F为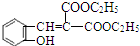 ,F发生信息I中反应生成G,C分子中含有2个六元环,则G为
,F发生信息I中反应生成G,C分子中含有2个六元环,则G为 .A的相对分子质量为60,由ClCH2COOH结构可知乙醇发生氧化反应生成A为CH3COOH,ClCH2COOH与氢氧化钠溶液反应、酸化得到C为HOCH2COOH,C发生催化氧化得到D为OHC-COOH,D与苯酚发生加成反应生成对羟基扁桃酸为
.A的相对分子质量为60,由ClCH2COOH结构可知乙醇发生氧化反应生成A为CH3COOH,ClCH2COOH与氢氧化钠溶液反应、酸化得到C为HOCH2COOH,C发生催化氧化得到D为OHC-COOH,D与苯酚发生加成反应生成对羟基扁桃酸为 .
.
(1)由上述分析可知,A的结构简式是CH3COOH,故答案为:CH3COOH;
(2)A生成的ClCH2COOH反应属于取代反应,故答案为:取代反应;
(3)C为HOCH2COOH,含氧官能团的名称是:羧基、羟基,故答案为:羧基、羟基;
(4)D→4-羟基扁桃酸的化学方程式是:OHC-COOH+ $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ ,
,
故答案为:OHC-COOH+ $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ ;
;
(5)E→F的化学方程式是:C2H5OOC-CH2-COOC2H5+ $\stackrel{吡啶}{→}$
$\stackrel{吡啶}{→}$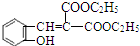 +H2O,
+H2O,
故答案为:C2H5OOC-CH2-COOC2H5+ $\stackrel{吡啶}{→}$
$\stackrel{吡啶}{→}$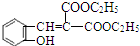 +H2O;
+H2O;
(6)F的结构简式是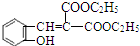 ,
,
a.不饱和碳原子连接2个-COOC2H5,没有顺反异构,故a错误;
b.F分子中不含醛基,故b错误;
c.含有碳碳双键与苯环,可以发生加成反应,含有酯基,可以发生水解反应,酯基、酚羟基均可以发生取代反应,故c正确,
故选:c;
(7)任意一种符合下列条件的4-羟基扁桃酸 (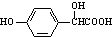 )的同分异构体:a.能发生水解和银镜反应的芳香族化合物,说明含有苯环、酯基、醛基,b.1mol该物质最多能与3mol NaOH发生反应,c.核磁共振氢谱显示有五个峰,峰面积之比为1:2:2:2:1,取代基可以是2个酚羟基、1个-CH2OOCH,可能的结构简式为:
)的同分异构体:a.能发生水解和银镜反应的芳香族化合物,说明含有苯环、酯基、醛基,b.1mol该物质最多能与3mol NaOH发生反应,c.核磁共振氢谱显示有五个峰,峰面积之比为1:2:2:2:1,取代基可以是2个酚羟基、1个-CH2OOCH,可能的结构简式为: ,
,
故答案为: ;
;
(8)由W→香豆素-3-羧酸的化学方程式为: $\stackrel{浓硫酸}{→}$
$\stackrel{浓硫酸}{→}$ +H2O,
+H2O,
故答案为: $\stackrel{浓硫酸}{→}$
$\stackrel{浓硫酸}{→}$ +H2O.
+H2O.
点评 本题考查有机物的推断与合成,需要学生对给予的信息进行利用,较好的考查学生自学能力,注意根据有机物的结构利用正、逆推法相结合进行推断,侧重考查学生分析推理能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2S和Na2O2的混合物中含有的阴离子数目大于0.1NA,小于0.2NA | |
| B. | 常温下0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| C. | 标准状况下,2.24L CHCl3的分子数为0.1NA | |
| D. | 19gT35Cl和H37Cl的混合物中所含中子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
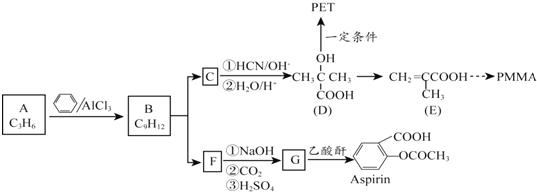
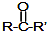 $→_{②H_{2}O/H+}^{①HCN/OH-}$
$→_{②H_{2}O/H+}^{①HCN/OH-}$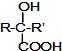
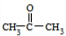 .
.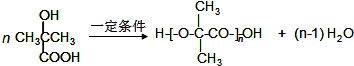 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
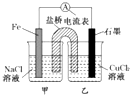
| A. | 原电池的总反应为 Fe+Cu2+=Fe2++Cu | |
| B. | 反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过0.2 mol电子 | |
| C. | 其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-=H2↑ | |
| D. | 盐桥中是KNO3溶液,则盐桥中NO3-移向乙烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 步骤及现象 |
 | i:往溶液中缓慢通入SO2,液面上方有红棕色气体,溶液黄色无明显变化 ii:继续通入足量的SO2,溶液变为深棕色,一段 时间后,溶液变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
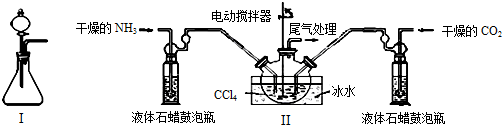
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置. | 溶液变浑浊,则证明固体中含有(NH4)2CO3. |
| 步骤3:取步骤2的上层清液于试管中加入少量的Ba(OH)2溶液. | 溶液不变浑浊,则证明固体中不含有NH4HCO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200 g 63%的浓硝酸中含氧原子个数为6NA | |
| B. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 若CH3COONa溶液中CH3COO-的数目为6NA,则Na+的数目大于6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com