
【题目】设NA为阿伏加德罗常数的值。关于常温下pH=5的NaH2PO4溶液,下列说法正确的是
A.溶液中含有的H+的数目为10-5NA
B.c(H+)+c(H3PO4)=c(OH-)+c(HPO![]() )
)
C.NaH2PO4溶液呈酸性是因为H2PO![]() 发生了水解反应
发生了水解反应
D.加入pH=5的稀硫酸,溶液的酸性不变
【答案】D
【解析】
A.溶液的体积不知,无法求算溶液中H+的物质的量,从而不知道H+的数目,A错误;
B.NaH2PO4溶液中,根据电荷守恒,有c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-),根据物料守恒,有c(Na+)=c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-),结合两式,可得c(H3PO4)+c(H+)=c(OH-)+c(HPO42-)+2c(PO43-),B错误;
C.H2PO4-水解方程式为H2PO4-+H2OH3PO4+OH-,水解成碱性;NaH2PO4溶液呈酸性,是由于H2PO4-的电离程度大于水解程度,C错误;
D.两个pH相同的溶液混合后,pH不变,D正确;
答案选D。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:固相法:2Li2SiO3+FeSO4![]() Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:

实验(二) Li2FeSiO4含量测定:

从仪器B中取20.00 mL溶液至锥形瓶中,另取0.2000 mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4- +5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00 mL | 19.98mL | 21.38mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B ,仪器C 。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是 。
(3)操作Ⅱ的步骤 ,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需 。
(4)还原剂A可用SO2,写出该反应的离子方程式 ,此时后续处理的主要目的是 。
(5)滴定终点时现象为 ;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量 。(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.4mol液态肼(N2H4)和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出H2O2电子式___;上述反应的热化学方程式______。
(2)已知H2O(l)=H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是____kJ。
(3)已知N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ·mol-1,N2H4(g)+O2(g)=N2(g)+2H2O (g);△H=-534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次递增的前四周期元素,A元素的正化合价与负化合价的代数和为零;B元素原子的价电子结构为nsnnpn;C元素基态原子s能级的电子总数比p能级的电子总数多1;D元素原子的M能层全满,最外层只有一个电子。请回答:
(1)A元素单质的电子式为________;B元素单质的一种空间网状结构的晶体,熔点>3550 ℃,该单质的晶体类型属于________________;基态D原子共有__________种不同运动状态的电子。
(2)A与C形成的最简单分子的中心原子杂化方式是__________,该分子与D2+、H2O以2∶1∶2的配比结合形成的配离子是_______(填化学式),此配离子中的两种配体的不同之处为_____________(填标号)。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数
③中心原子的化学键类型 ④VSEPR模型
(3)1 mol BC-中含有的π键数目为________;写出与BC-互为等电子体的分子和离子各一种________、_________(填化学式)。
(4)D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,其原因是___________________________。
(5)D3C具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3-半径分别为a pm、b pm,D+和C3-都是紧密接触的刚性小球,则C3-的配位数为________,晶体的密度为_____ g·cm-3。
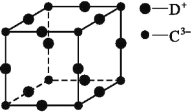
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新冠病毒(如图)由蛋白质和核酸组成,核酸由核苷酸组成,核苷酸的单体由五碳糖、磷酸基和含氮碱基构成。下列说法错误的是
A.蛋白质和核酸均是高分子化合物
B.五碳糖(C5H10O5)与葡萄糖互为同系物
C.蛋白质中含C、H、O、N等元素
D.NaClO溶液用作消毒剂,是因为NaClO能使病毒蛋白变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的KOH溶液时,导致浓度偏低的原因可能是( )
A. 用敞口容器称量KOH且时间过长
B. 配置前先向容量瓶中加入少量蒸馏水
C. 容量瓶盛过KOH溶液,使用前未洗涤
D. 溶解后快速转移到容量瓶,然后加足量蒸馏水,定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OCH3(二甲醚)常用作有机合成的原料,也用作溶剂和麻醉剂。CO2与H2合成CH3OCH3涉及的相关热化学方程式如下:
Ⅰ.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
Ⅱ.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
Ⅲ.CO2(g)+H2(g)![]() CO(g)+H2(g) ΔH3
CO(g)+H2(g) ΔH3
Ⅳ.2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH4
CH3OCH3(g)+3H2O(g) ΔH4
回答下列问题:
⑴ΔH4=__kJ·mol-1。
⑵体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应能自发进行。反应Ⅰ、Ⅱ、Ⅲ的自由能变与温度的关系如图a所示,在298~998K下均能自发进行的反应为__(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
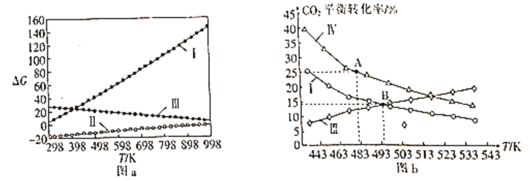
⑶在三个完全相同的恒容密闭容器中,起始时均通入3molH2和1molCO2,分别只发生反应Ⅰ、Ⅲ、Ⅳ时,CO2的平衡转化率与温度的关系如图b所示。
①ΔH3__0(填“>”或“<”)。
②反应Ⅳ,若A点总压强为pMPa,则A点时CO2的分压为p(CO2)__pMPa(精确到0.01)。
③在B点对应温度下, K(Ⅰ)__(填“大于”“小于”或“等于”)K(Ⅲ)。
⑷向一体积为1L的密闭容器中通入H2和CO2,只发生反应Ⅳ。CO2的平衡转化率与压强、温度及氢碳比m[m=![]() ]的关系分别如图c和图d所示。
]的关系分别如图c和图d所示。

①图c中压强从大到小的顺序为__,图d中氢碳比m从大到小的顺序为__。
②若在1L恒容密闭容器中充入0.2molCO2和0.6molH2,CO2的平衡转化率为50%,则在此温度下该反应的平衡常数K=__(保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
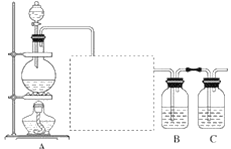
(1)装置A的分液漏斗中盛装的试剂是______,烧瓶中发生的反应的化学方程式是________。
(2)画出虚线框内的实验装置图,所加试剂为____________,该装置的作用是_______。
(3)装置B中盛放的试剂是____________(填序号),实验现象为____________,该反应的离子方程式是_____________,该反应属于四种基本反应类型中的__________反应。
A Na2S溶液 B Na2SO3溶液 C Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸的酸性比硫酸强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气在加热条件下反应生成三氯化铁,铁与硫在加热条件下反应生成硫化亚铁;⑦硫原子与氯原子的电子层数相同,氯的原子半径小于硫原子。能说明氯的非金属性比硫强的是________(填序号)。
A 全部 B ②③④⑥⑦ C ①②④⑤⑥ D ②③④⑤⑥⑦
(5)装置C中盛放烧碱溶液,目地是吸收反应后剩余的气体,防止污染空气,写出该装置中所发生反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2与Na2S溶液反应的产物中含有Cl-和SO32-,某课外实验小组为了探究两溶液反应的产物中不含SO32-而含有Cl-,设计了如下实验:

(1)在装置II中NaOH溶液的作用是___,ClO2和NaOH溶液反应生成等物质的量的两种盐,其中一种盐为NaClO2,写出该反应的离子方程式___。
(2)请补充完整实验步骤:把用氮气稀释后的足量ClO2通入I中的Na2S溶液中充分反应,得到无色澄清溶液。
i取少量I中的溶液于试管甲中,滴加品红溶液和盐酸,品红不褪色,证明溶液中无SO2。
ii另取少量I中的溶液于试管乙中,___,证明溶液中含有Cl-。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com