
I.用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
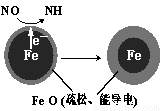
正极的电极反应式是 。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24 | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是 。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe 2+直接还原NO3-;Ⅱ.Fe2+破坏FeO(OH)氧化层。
2+直接还原NO3-;Ⅱ.Fe2+破坏FeO(OH)氧化层。
① 对比实验,结果如图所示,可得到的结论是 。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因: 。
II.高铁酸钠Na2FeO4 是一种新型净水剂。
(4)高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH= 2Na2FeO4+3X+5H2O,则X的化学式为__________。
(5)高铁酸钠具有强氧化性,与水反应生成Fe(OH)3胶体能够吸附水中悬浮杂质,请写出高铁酸钠与水反应的离子方程式 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年江苏省高二上期中选修化学卷(解析版) 题型:选择题
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g);ΔH <0的化学反应下列叙述不正确的是

A.反应过程中能量关系可用如图表示
B.若将该反应设计成原电池锌为负极
C.ΔH的值与反应方程式的计量系数无关
D.若将其设计为原电池当有32.5g锌溶解时,正极放出气体一定为11.2L
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:填空题
25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | |
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是___________(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是__________
A.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
B.ClO-+CH3COOH=CH3COO-+HClO
C.CO32-+HClO=CO2↑+H2O+ClO-
D.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是___________
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH) C.c(H+)/ KW D.c(H+)/c(OH-)

(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图,则HX的电离平衡常数___________(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的 c(H+)______________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或 “小于”)
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:选择题
能证明乙酸是弱酸的实验事实是
A.CH3COOH溶液与Zn反应放出H2
B.0.1 mol/L CH3COONa溶液的pH大于7
C.CH3COOH溶液与Na2CO3反应生成CO2
D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:选择题
下列化学现象及解释错误的是
选项 | 现象 | 解释 |
A | Cl2在H2中点燃,瓶口有白雾 | 生成HCl极易溶于水 |
B | 饱和Na2CO3溶液中通入CO2析出白色晶体 | 生成NaHCO3溶解度小析出 |
C | 常温下将铝片放入浓硝酸中无明显变化 | Al和浓硝酸不反应 |
D | SO2通入溴水,溴水褪色 | SO2具有还原性。 |
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上期中化学试卷(解析版) 题型:选择题
下列化学反应先后顺序判断正确的是( )
A.向含有等物质的量的Ba(OH)2、KOH的混合溶液中通入CO2,与CO2反应的物质依次是:KOH、 Ba(OH)2、BaCO3
B.向 含有等物质的量的Fe2+、Ag+、Cu2+的混合溶液中加入Zn,与Zn反应的离子依次是:Ag+、Cu2+、Fe2+
含有等物质的量的Fe2+、Ag+、Cu2+的混合溶液中加入Zn,与Zn反应的离子依次是:Ag+、Cu2+、Fe2+
C.向含有等物质的量的AlO2-、OH-、CO32-的混合溶液中滴加盐酸,与盐酸反应的物质依次是 :AlO2-、Al(OH)3、OH-、CO32-
D.在含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气,与氯气反应的离子依次是:I-、Br-、Fe2+
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上期中化学试卷(解析版) 题型:选择题
O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A.标准状况下,若生成4.48 L HF,则转移0.8 mol电子
B.O2F2既是氧化剂又是还原剂
C.还原剂与氧化剂的物质的量之比为1:4
D.氧气是氧化产物
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期月考二化学试卷(解析版) 题型:推断题
A、B、C、D、X、Y 为元素周期表中六种主族元素,其原子序数依次增大,均小于54;常温下 A2B呈液态;高纯 C单质是良好的半导体材料; D、X、Y 原子最外层电子数均为 7;过渡元素 Z与 B可形成多种化合物,其中红棕色粉末 Z2B3常用作红色油漆和涂料。
请按要求回答下列问题:
(1)将D2的水溶液加入浅绿色的 ZD2溶液中发生反应的离子方程式为______________。
(2)学生甲认为 X2和 Y2都可能将 Z2+氧化为 Z3+,他推理的依据是_______________。
(3)学生乙认为 X2能将 Z2+氧化为 Z3+,但 Y2不能。学生乙推理的依据是____________。
(4)A与 B可形成既含极性键又含非极性键的化合物 W。 W 的水溶液呈弱酸性,常用作无污染的消毒杀菌剂等。
①W 的电子式为___________,W 的第一步电离方程式为____________。
②如果配制 W 溶液的水中含有 Z3+,会削弱 W 的消毒杀菌能力,甚至会完全失去杀菌作用。试用化学方程式表示其原因:________________。
(5)铅(Pb)、锡(Sn)、锗(Ge)与元素 C 同主族;常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
①锗的原子序数为___________;
②它们+4 价氢氧化物的碱性由强到弱的顺序为_______________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com