
| A. | 10min内,反应放出的热量为197kJ热量 | |
| B. | 10min内,X的平均反应速率为0.06mol•L-1•min-1 | |
| C. | 第10min时,Y的反应速率小于0.015mol•L-1•min-1(假如体系温度不变) | |
| D. | 第10min时,Z浓度为0.6mol•L-1 |
分析 A.可逆反应的热化学方程式中的焓变是指反应完全进行时的热量的变化;
B.根据v=$\frac{△c}{△t}$计算v(X);
C.反应过程中随着反应物浓度的减小,反应速率是逐渐减小的,据此判断;
D.反应10min,测得X的物质的量为1.4mol,即有0.6mol的X参加反应,根据反应方程式2X(g)+Y(g)?Z(g)可计算出生成的Z的物质的量浓度,据此判断.
解答 解:A.可逆反应的热化学方程式中的焓变是指反应完全进行时的热量的变化,根据题意,如果2moX全部 参加反应,则可放出197kJ的热,所以当反应10min时,测得X的物质的量为1.4mol,即X没有完全参加反应,所以放出的热量小于197kJ,故A错误;
B.根据v=$\frac{△c}{△t}$可知,v(X)=$\frac{\frac{0.6mol}{2L}}{10min}$=0.03mol•L-1•min-1,故B错误;
C.根据题意,在10min内,Y的平均速率=$\frac{1}{2}$v(X)=0.015mol•L-1•min-1,反应过程中随着反应物浓度的减小,反应速率是逐渐减小的,所以第10min时,Y的反应速率小于0.015mol•L-1•min-1,故C正确;
D.反应10min,测得X的物质的量为1.4mol,即有0.6mol的X参加反应,根据反应方程式2X(g)+Y(g)?Z(g)可知生成的Z的物质的量为0.3mol,所以第10min时,Z浓度为$\frac{0.3}{2}$mol•L-1=0.15mol•L-1,故D错误,
故选C.
点评 本题考查化学平衡计算,涉及反应热、反应速率、平衡浓度等,难度中等,注意反应物的起始物质的量之比等于化学计量数之比则转化率相等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
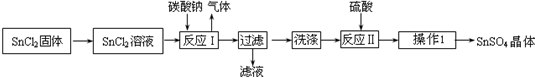
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
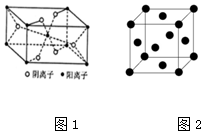 W、X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;W是形成有机物种类最多的元素;R2+的3d轨道中有9个电子.请回答:
W、X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;W是形成有机物种类最多的元素;R2+的3d轨道中有9个电子.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-484kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
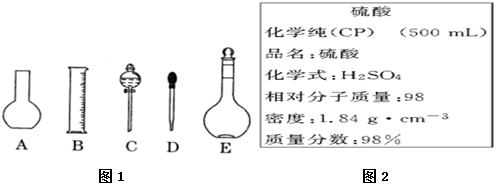
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H(中和热) | |
| B. | $\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H(中和热) | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H (燃烧热) | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H(燃烧热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 58.5g NaCl含有NA个分子 | |
| B. | 1mol N2和3mol H2充分反应,有6NA电子转移 | |
| C. | 标准状况下,22.4LCHCl3含有分子数为NA | |
| D. | 46g NO2和N2O4混合气体含有的原子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com