
| A、用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu═2Fe2++Cu2+ |
| B、氢氧化钡溶液跟硫酸反应:OH-+H+═H2O |
| C、碳酸钙与盐酸反应:2H++CO32-=H2O+CO2↑ |
| D、氧化铜与稀硫酸混合:CuO+H+═Cu2++H2O |


科目:高中化学 来源: 题型:
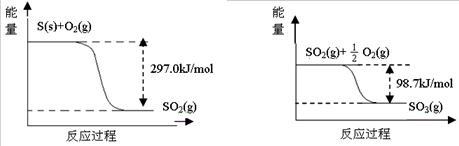
| A、1mol S(g)与O2(g)完全反应生成SO2(g),反应放出的热量小于297.0kJ/mol | ||
B、一定条件下1molSO2(g)和
| ||
| C、在相同条件下,SO3(g)比SO2(g)稳定 | ||
D、S(s)与O2(g)反应生成SO3(g)的热化学方程式S(s)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离的c(H+):①=②>③=④ |
| B、将①、④两种溶液混合后,若pH=7,则消耗溶液的体积:①>④ |
| C、①②的导电性不同,③④的导电性也不同 |
| D、向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
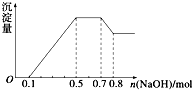 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )| A、溶液中的阳离子有H+、Mg2+、NH4+、Al3+ |
| B、溶液中n (Al3+)=0.2mol |
| C、溶液中一定不含CO32-,可能含有SO42-和NO3- |
| D、n(H+):n(Al3+):n(Mg2+)=2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 |
| B、相同 pH的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) |
| C、0.1 mol?L-1的NaHA溶液pH=5,则溶液中:c(HA-)>c(H+)>c(A2-)>c(H2A) |
| D、向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
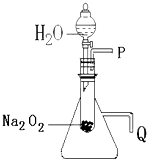 用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ Ba2+ Mg2+ NH4+ Na+ Al3+ |
| 阴离子 | SO42- SO32- C032- AlO2- Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com