
| A. | c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | B. | c(Na+)+c(H+)═c(S2-)+c(HS-)+c(OH-) | ||
| C. | c(Na+)═c(HS-)+2c(H2S)+2c(S2-) | D. | c(OH-)═c(H+)+c(HS-)+c(H2S) |
分析 硫化钠是二元弱酸的正盐,硫离子有两步水解且第一步水解程度远远大于第二步,两步水解导致溶液呈碱性,但溶液中仍然存在电荷守恒和物料守恒,根据电荷守恒和物料守恒分析解答.
解答 解:A.Na2S是强碱弱酸盐,S2-水解导致溶液呈碱性,但其水解程度较小,水电离也生成氢氧根离子,所以溶液中离子浓度大小顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),故A正确;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)═2c(S2-)+c(HS-)+c(OH-),故B错误;
C.溶液中存在物料守恒,根据物料守恒得c(Na+)═2c(HS-)+2c(H2S)+2c(S2-),故C错误;
D.根据电荷守恒得c(Na+)+c(H+)═2c(S2-)+c(HS-)+c(OH-)、根据物料守恒得c(Na+)═2c(HS-)+2c(H2S)+2c(S2-),所以得c(OH-)═c(H+)+c(HS-)+2c(H2S),故D错误;
故选A.
点评 本题考查离子浓度大小比较,为高频考点,侧重考查分析判断及守恒思想的运用能力,根据电荷守恒、物料守恒及原子守恒分析解答,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
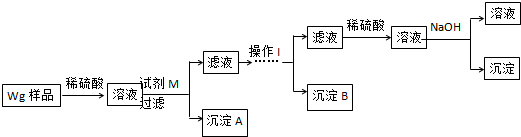
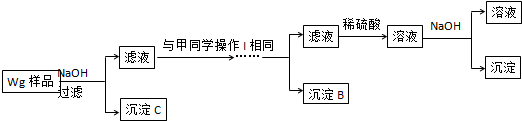
 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯分子中均含有碳碳双键,二者都能发生加成反应 | |
| B. | 汽油、煤油、植物油均为含碳、氢、氧三种元素的化合物 | |
| C. | 苯、乙醇和乙酸都能发生取代反应 | |
| D. | 羊毛、蚕丝和棉花等天然高分子材料的主要成分都是蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
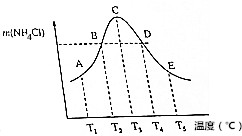 ( )
( )| A. | 不同温度下的平衡常数K3<K4<K5 | |
| B. | 正反应速率:vB=vD | |
| C. | 当体系气体的平均相对分子质量不再改变时,不能说明反应达到平衡状态 | |
| D. | A、B、D、E点均未达到平衡状态,C点达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 101 kPa时,2 g H2完全燃烧生成液态水放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (2)乙炔的结构式H-C≡C-H
(2)乙炔的结构式H-C≡C-H查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验氯乙烷中的氯元素,水解后再用硫酸酸化 | |
| B. | 为了增强KMnO4溶液的氧化能力,用浓盐酸酸化 | |
| C. | 为了抑制Fe2+的水解,用稀硝酸酸化 | |
| D. | 检验溶液中是否含有SO42-时,先用盐酸酸化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com