
(15分)催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺。
(1)接触法制硫酸中采用V2O5作催化剂:
4FeS2(s)+11O2(g)=2Fe2O3(s) +8SO2(g) △H=―3412 kJ·mol-1
2SO2(g)+O2(g)  2SO3(g) △H=―196.6 kJ·mol-1
2SO3(g) △H=―196.6 kJ·mol-1
SO3(g)+H2O(l)=H2SO4(l) △H=―130.3 kJ·mol-1
以FeS2为原料,理论上生产2mol H2SO4(l)所释放出的热量为 kJ。
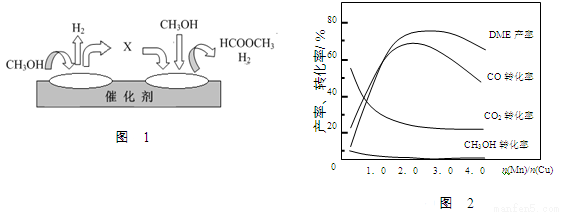
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g)+CO(g) △H>0
CH3OH(g)+CO(g) △H>0
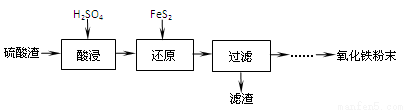
①第一步反应的机理可以用图1所示。图中中间产物X的结构简式为 。
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ;
b.沉淀: ;
c.分离,洗涤;
d.烘干,研磨。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年宁夏银川一中高三第二次模拟考试 理综化学试卷(解析版) 题型:选择题
用式量是57的烃基取代甲苯苯环上的一个氢原子,能得到的有机物种数为
A.4种 B.8种 C.12种 D.24种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省等高三下学期期中四校联考化学试卷(解析版) 题型:选择题
如图是达到平衡后,外界条件变化时,2SO2(g)+O2(g)  2SO3(g);
2SO3(g); H<0反应速率的变化情况(
H<0反应速率的变化情况( /表示正反应速率,
/表示正反应速率,  //表示逆反应速率)。下列说法中正确的是
//表示逆反应速率)。下列说法中正确的是
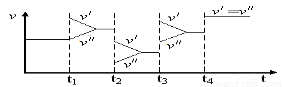
A.t1时改变的条件是增大体系的压强 B.t2时改变的条件是减小压强
C.t3时改变的条件是升高温度 D.t4时改变的条件是使用了催化剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长沙市高三第二次联考理综化学试卷(解析版) 题型:实验题
(14分)已知SO2可以用Fe(NO3)3溶液吸收,某学习小组据此按下图装置展开如下相关探究:取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热。装置A中有白雾(硫酸酸雾)生成, 装置B中产生白色沉淀。
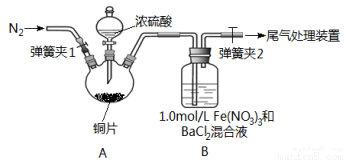
回答下列问题:
(1)装置A中用于添加浓硫酸的仪器名称为 ;检查图中连通装置A、B气密性的方法是 。
(2)加入浓硫酸之前先通人N2一段时间,其目的是 ;排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是 。若用氢氧化钠溶液处理尾气,则发生反应的离子方程式为 。
(3)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加):
假设1:装置A中白雾进入装置B中参与了反应。
假设2: 。
假设3:Fe(NO3)2溶液显酸性,在此酸性条件下NO3能氧化SO2。
(4)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
①测1.0molL1Fe(NO3)3溶液的pH; ② ③ ④ |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长沙市高三第二次联考理综化学试卷(解析版) 题型:选择题
某有机物X的结构简式如下图所示,则下列有关说法中正确的是:
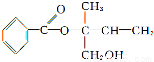
A.X的分子式为C12H16O3
B.可用酸性高锰酸钾溶液区分苯和X
C.X在一定条件下能发生加成、加聚、取代、消去等反应
D.在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2 加成
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三综合能力测试(五)理综化学试卷(解析版) 题型:选择题
分子式为C5H12O的饱和一元醇与和它相对分子质量相同的饱和一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构)
A.13种 B.14种 C.15种 D.16种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三二模考试理综化学试卷(解析版) 题型:简答题
[化学——选修2]化学与技术:(15分)硫酸是重要的工业原料.工业上生产硫酸主要分为造气、催化氧化、吸收三个阶段,其生产流程图如下:
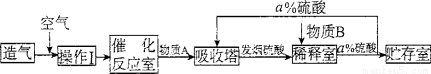
(1)操作I的内容是 ,此操作目的是 .物质B是 .a= 。
(2)工业上既可用硫黄也可用硫铁矿(FeS2)造气,若使用硫铁矿造气.另一产物是一种常见的红棕色固体.写出用硫铁矿造气时反应的化学方程式 。
(3)催化反应室中的反应是一个气体体积缩小的反应.增大压强有利于反应向右进行.但实际生产却是在常压下进行的.原因是 。
(4)工业生产中常用氨一硫酸法进行尾气脱硫,以达到消除污染、废物利用的目的.用两个化学方程式表示其反应原理 。
(5)若用等质量的硫黄、FeS2生产硫酸.假设原料的总利用率均为90%.则二者得到硫酸的质量比为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三下学期三调考试化学试卷(解析版) 题型:选择题
关于下列四个装置的说明符合实验要求的是
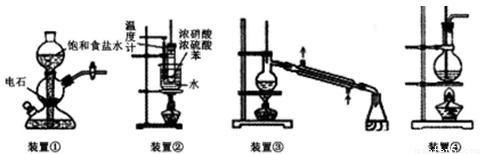
A.装置①:实验室中若需制备较多量的乙炔可用此装置
B.装置②:实验室中可用此装置来制备硝基苯,但产物中可能会混有苯磺酸
C.装置③:实验室中可用此装置来分离含碘的四氯化碳液体,最终在锥型瓶中可获得碘
D.装置④:实验室中可用此装置来制备乙酸乙酯并在烧瓶中获得产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com