
【题目】如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。

现欲用该浓硫酸配制成1mol/L的稀硫酸,现实验室仅需要这种稀硫酸220mL。试回答下列问题:
(1)用量筒量取该浓硫酸____________mL。
(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是____。
(3)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是__________。
A.用量筒量取浓硫酸时俯视
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切
E.容量瓶不干燥
F.定容时,仰视容量瓶刻度线
(4)某同学用固体Na2CO3配制500 mlL 0.1molL-1溶液的过程如图所示:
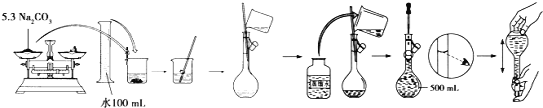
你认为该同学的错误步骤有__________处。
【答案】13.6 250mL容量瓶和胶头滴管 BC 2
【解析】
(1)由标签数据,利用公式c=![]() 计算出浓硫酸的浓度,欲配制220mL的溶液,需选用250mL容量瓶;再根据稀释定律计算出需要的浓硫酸的体积;
计算出浓硫酸的浓度,欲配制220mL的溶液,需选用250mL容量瓶;再根据稀释定律计算出需要的浓硫酸的体积;
(2)配制溶液时需要量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管;
(3)A.用量筒量取浓硫酸时俯视,导致量取的浓硫酸的体积偏小;
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中,冷却后溶液的体积缩小;
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中,溶质的物质的量增大;
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切,加入的溶剂过多;
E.容量瓶不干燥,不影响溶液的浓度;
F.定容时,仰视容量瓶刻度线,读得的溶液的体积增大;
(4)配制500 mlL 0.1molL-1溶液需要的固体Na2CO3的质量为0.1mol/L×0.5L×106g/mol=5.3g,加入少量水溶解后,冷却至室温,沿玻璃棒将溶液引流入500mL的容量瓶中,洗涤烧杯和玻璃棒2-3次,将洗涤液也注入容量瓶中,摇匀后项容量瓶中加水至距刻度线1-2cm处,改用胶头滴管滴加水至凹液面最低点与刻度线相切,摇匀,溶液配制完成,据此分析配制过程的正确与否。
(1)根据标签中的数据可知,浓硫酸的浓度c=![]() =
=![]() =18.4mol/L,欲配制1mol/L的稀硫酸220mL,需要用容量瓶配制250mL溶液,利用稀释定律可得出需要浓硫酸的体积V(浓)=
=18.4mol/L,欲配制1mol/L的稀硫酸220mL,需要用容量瓶配制250mL溶液,利用稀释定律可得出需要浓硫酸的体积V(浓)=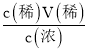 =
=![]() =0.0136L=13.6mL;
=0.0136L=13.6mL;
(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是250mL容量瓶和胶头滴管;
(3)A.用量筒量取浓硫酸时俯视,导致量取的浓硫酸的体积偏小,配制的溶液中溶质的物质的量偏小,因此溶液的浓度偏小,A项不符合题意;
B. 稀释浓硫酸时,未冷却到室温即转移到容量瓶中,冷却后溶液的体积缩小,导致溶液的浓度偏高,B项符合题意;
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中,溶质的物质的量增大,导致溶液的浓度偏高,C项符合题意;
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切,加入的溶剂过多,导致溶液的浓度偏低,D项不符合题意;
E.容量瓶不干燥,不影响溶液的浓度,E项不符合题意;
F.定容时,仰视容量瓶刻度线,读得的溶液的体积增大,导致溶液的浓度偏低,F项不符合题意;
溶液浓度偏高的是BC;
(4)溶解冷却后的碳酸钠溶液转移入容量瓶,再将洗涤液也转移入容量瓶中后,将溶液摇匀,图中没有摇匀的步骤;用胶头滴管滴加水时,视线要平视,因此错误的步骤有2处。


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)写出电子式:KOH________________________;CO2_______________________
(2)用电子式表示下列化合物的形成过程:CaF2:___________________________________
H2S:____________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的刚性密闭容器中加入1molCO2和3molH2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。在其他条件不变的情况下,温度对反应的影响如图所示(注:T1、T2均大于300℃)。下列说法正确的是( )
CH3OH(g)+H2O(g)。在其他条件不变的情况下,温度对反应的影响如图所示(注:T1、T2均大于300℃)。下列说法正确的是( )
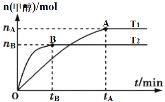
A.该反应在T1时的平衡常数比在T2时的小
B.处于A点的反应体系从T1变到T2,达到平衡时![]() 减小
减小
C.T2时,反应达到平衡时生成甲醇的反应速率v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
D.T1时,若反应达到平衡后CO2的转化率为x,则容器内的压强与起始压强之比为(2-x)∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
容器 编号 | 容器类型 | 起始物质的量 / mol | 平衡时SO3的物质的量 / mol | ||
SO2 | O2 | SO3 | |||
I | 恒温恒容 | 2 | 1 | 0 | 1.8 |
II | 恒温恒压 | 2 | 1 | 0 | a |
III | 绝热恒容 | 0 | 0 | 2 | b |
A. 容器I中SO2的转化率小于容器II中SO2的转化率
B. 容器II的平衡常数大于容器III中的平衡常数
C. 平衡时SO3的物质的量:a>1.8、b>1.8
D. 若起始时向容器I中充入0.10 mol SO2(g)、0.20mol O2(g)和2.0 mol SO3(g),则此时v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近意大利科学家获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知Ⅰ、断裂1 mol N—N吸收167 kJ热量,形成1 mol ![]() 放出942 kJ热量;Ⅱ、N2(g)+3H2(g)
放出942 kJ热量;Ⅱ、N2(g)+3H2(g)![]() 2NH3(g) ΔH1=-92 kJ/mol,N4(g)+6H2(g)
2NH3(g) ΔH1=-92 kJ/mol,N4(g)+6H2(g)![]() 4NH3(g) ΔH2(kJ/mol)根据以上信息和数据,下列说法正确的是( )
4NH3(g) ΔH2(kJ/mol)根据以上信息和数据,下列说法正确的是( )
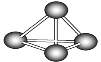
A.ΔH2>0B.N2分子比N4分子稳定
C.ΔH2=2ΔH1D.ΔH2与方程式系数无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液中可能存在大量Ag+、Mg2+、Fe3+、Cu2+中的一种或几种,请填写下列空白。
(1)不用做任何实验就可以肯定溶液中不存在的离子是________________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明原溶液中肯定存在的离子是_______,有关反应的离子方程式为___________。
(3)取(2)的滤液加过量的NaOH溶液,出现白色沉淀,说明原溶液中肯定有________,有关反应的离子方程式为_________________________。
(4)原溶液中可能大量存在的阴离子是________(填序号)。
A.Cl- B.NO3- C. CO32- D.OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分散系的叙述不正确的是( )

A. 分散系的分类:![]()
B. 用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分
C. 把FeCl3饱和溶液滴入到氢氧化钠溶液中,以制取Fe(OH)3胶体
D. 如图显示的是树林的晨曦,该现象与丁达尔效应有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由黏土(主要成分Al2O3·2SiO2·2H2O,含少量Fe2O3、CaO、MgO等杂质)与磷肥生产的含氟废气生产冰晶石Na3AlF6的工艺流程如下:
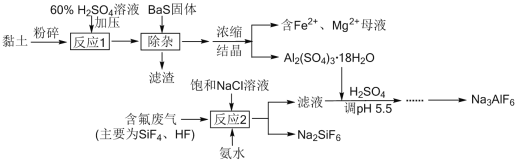
请回答下列问题:
(1) 冰晶石在电解Al2O3制铝中的作用是______,需定期更换石墨______(填“阳”或“阴”)极。
(2) 不用98%硫酸进行“反应1”的可能原因是______。
A.不易发生离子反应,造成浸出率下降
B.反应速率太快太剧烈,造成了操作危险
C.产生较多酸性废液,也提高了原料成本
(3) 保持其他条件不变,反应1的铝浸出率在不同温度下随时间变化如图所示。“反应1”的最佳温度与时间分别是______℃、______min。

(4) “除杂”步骤产生的“滤渣”中含有BaSO4、CaSO4、S等难溶物,写出产生S的离子方程式______。
(5) 若按“黏土![]() 滤液
滤液![]() 溶液
溶液![]() ”来制备Al2(SO4)3·18H2O,该方案的原料利用率比原方案更______ (填“高”或“低”)。
”来制备Al2(SO4)3·18H2O,该方案的原料利用率比原方案更______ (填“高”或“低”)。
(6) “反应2”所得“滤液”中含氟物质主要为______ (写化学式)。
(7) 已知Ka(HF)= 6.4×10-4,Al3++ 6F-![]() AlF
AlF![]() 的K=1.0×1019,欲使平衡时c(AlF
的K=1.0×1019,欲使平衡时c(AlF![]() )/c(Al3+)≥10,且调节并维持滤液pH=5.5,则其中HF平衡浓度应不低于______mol/L(保留2位有效数字,100.5≈ 3.2)。
)/c(Al3+)≥10,且调节并维持滤液pH=5.5,则其中HF平衡浓度应不低于______mol/L(保留2位有效数字,100.5≈ 3.2)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质两两混合,不能用Ca2++![]() ═CaCO3↓表示的是( )
═CaCO3↓表示的是( )
A.Ca(OH)2与Na2CO3B.CaCl2与K2CO3
C.CaCl2与Na2CO3D.Ca(OH)2与(NH4)2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com