

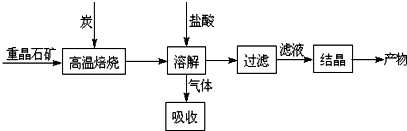
分析 烧渣主要成份为Fe2O3、Al2O3和SiO2,不考虑其他杂质,与过量NaOH溶液混合,离子反应方程式为SiO2+2OH-=SiO32-+H2O、Al2O3+2OH-=2AlO2-+H2O;Fe2O3和NaOH不反应,然后过滤得到的固体B为Fe2O3为8.0g,溶液A中含有Na+、AlO2-、SiO32-和OH-,加入过量盐酸,发生的反应为离子反应方程式为OH-+H+=H2O、AlO2-+4H+=Al3++2H2O、SiO32-+2H+=H2SiO3↓,然后过滤得到的固体F为H2SiO3↓,灼烧脱水得SiO2为0.6g;固体B为Fe2O3为加过量试剂C溶解,因为要制备FeSO4•7H2O,所以试剂C为稀硫酸,发生反应为:Fe2O3+6H+=2Fe3++3H2O,所得溶液D为硫酸铁和过量稀硫酸的混合溶液,再加试剂E将三价铁还原成二价铁,所以试剂E为铁单质,反应的离子方程式是Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,最后将硫酸亚铁溶液进行蒸发浓缩、冷却结晶、过滤得到绿矾,据此分析.
解答 解:(1)通过以上分析知,溶液A中含有的阴离子主要有AlO2-、SiO32-和OH-,故答案为:OH-;
(2)通过以上分析知,试剂C是稀硫酸,故答案为:稀硫酸;
(3)通过以上分析知,③中反应的离子方程式是Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,故答案为:Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑;
(4)通过以上分析知,SiO2为0.6g,Fe2O3为8.0g,所以Al2O3为13.7-8.0-0.6=5.1g,则烧渣中Fe2O3、Al2O3和SiO2的物质的量之比是$\frac{8.0}{160}$:$\frac{5.1}{102}$:$\frac{0.6}{60}$=5:5:1,故答案为:5:5:1.
点评 本题考查物质制备,为高频考点,侧重考查学生分析推断及综合应用能力,明确流程图中发生的反应及物质分离提纯方法是解本题关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
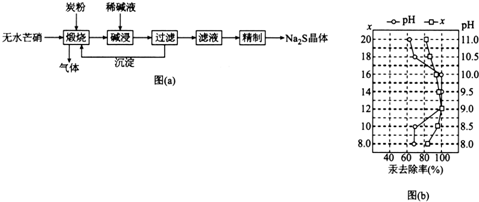
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 苯甲酸乙酯(C9H10O2)有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,其制备步骤如下:
苯甲酸乙酯(C9H10O2)有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,其制备步骤如下: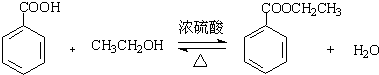 .
.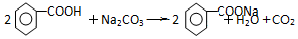 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 +CH2OH5$\stackrel{催化剂}{→}$
+CH2OH5$\stackrel{催化剂}{→}$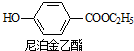 +H2O
+H2O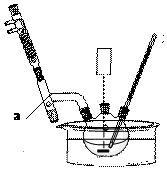
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
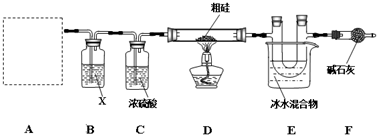
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个C-H键的长度相等 | B. | 4个C-H键的强度相同 | ||
| C. | 4个C-H键的夹角相同 | D. | 4个C-H连接成正方形 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
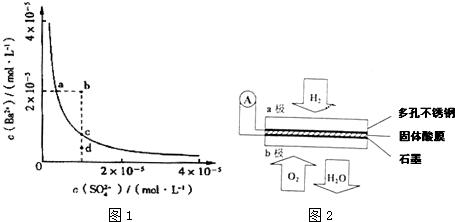
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
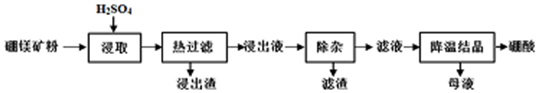
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com