
【题目】室温下,对于pH=11的氨水,下列判断正确的是
A. 该氨水的浓度为1.0×10-3mol·L-1
B. 加水稀释,溶液中所有离子的浓度均减小
C. 加水稀释,溶液中c(NH4+)/c(NH3·H2O)变大
D. 与pH=3的盐酸等体积混合,反应后溶液pH=7
【答案】C
【解析】A. 氨水是弱碱,不能完全电离,pH=11的氨水,该氨水的浓度大于1.0×10-3mol·L-1,故A错误;B. NH3·H2O![]() NH4++OH-,加水稀释,溶液中的主要存在离子浓度均会减小,但温度不变,水的离子积常数不变,则c(H+)增大,故B错误;C. NH3·H2O
NH4++OH-,加水稀释,溶液中的主要存在离子浓度均会减小,但温度不变,水的离子积常数不变,则c(H+)增大,故B错误;C. NH3·H2O![]() NH4++OH-,加水稀释,溶液的碱性减弱,c(OH-)减小,但电离常数不变,则溶液中c(NH4+)/c(NH3·H2O)变大,故C正确;D. 氨水是弱碱,不能完全电离,pH=11的氨水,该氨水的浓度大于1.0×10-3mol·L-1,与pH=3的盐酸等体积混合,氨水过量,反应后溶液pH大于7,故D错误;故选C。
NH4++OH-,加水稀释,溶液的碱性减弱,c(OH-)减小,但电离常数不变,则溶液中c(NH4+)/c(NH3·H2O)变大,故C正确;D. 氨水是弱碱,不能完全电离,pH=11的氨水,该氨水的浓度大于1.0×10-3mol·L-1,与pH=3的盐酸等体积混合,氨水过量,反应后溶液pH大于7,故D错误;故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知NO2与N2O4可相互转化:2NO2(g)![]() N2O4(g) ΔH=-24.2 kJ·mol-1,在恒温下,将一定量NO2和N2O4的混合气体充入体积为2 L的密闭容器中,其中物质的量浓度随时间变化的关系如右图所示。下列推理分析不合理的是( )
N2O4(g) ΔH=-24.2 kJ·mol-1,在恒温下,将一定量NO2和N2O4的混合气体充入体积为2 L的密闭容器中,其中物质的量浓度随时间变化的关系如右图所示。下列推理分析不合理的是( )
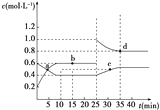
A. 前10 min内,用v(NO2)表示的反应速率为0.02 mol·L-1·min-1
B. 反应进行到10 min时,体系吸收的热量为9.68 kJ
C. b、d两点中v(正)与v(逆)均相等
D. 25 min时,正反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上尝试用太阳能分解水制取H2,其过程如下:
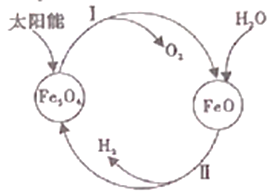
已知:2H2O(l)=2H2(g)+O2(g) △H=+571.6kJ/mol
2Fe3O4(s)![]() 6FeO(s)+O2(g) △H=+313.8kJ/mol
6FeO(s)+O2(g) △H=+313.8kJ/mol
①过程I中,需将O2及时分离出去,目的是_________。
②过程II的热化学方释式是_________。
③整个过程中,Fe3O4的作用是_________。
(2)工业上利用H2合成氢的反应原理为:3H2(g)+N2(g) ![]() 2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
容器 | 甲 | 乙 |
反应物投入量 | 2molH2、2molN2 | 4malH2.4molN2 |
平衡时N2的浓度(mol/L) | c1=1.5 | c2 |
NH3的体积分数 | ω1 | ω2 |
混合气体的密度(g/L) | ρ1 | ρ2 |
①下列情况下,反应达到平衡状态的是_____(填序号)
a.3molH-H共价键断裂同时有6molN-H共价键形成
b.3v正(N2)=v逆(H2)
c.混合气体的平均相对分子质量保持不变
②反应的平衡常数K=_______(结果保留3位有效数字).
③分析上表中的数据,有以下关系:c2________3mol/L;ω1________ω2(填“>”、“<”、“=”);若ρ1=ag/L,则ρ2________g/L(用含a的式子表示)
(3)利用氨水吸收工业废气中的SO2,既可解决环境问题,又可制备(NH4)2SO3。可用(NH4)2SO3为原料,以空气氧化法制备(NH4)2SO4,其氧化速率与温度关系如下图:
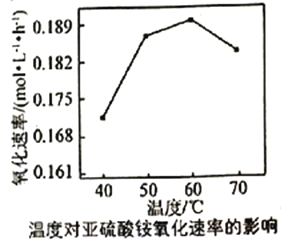
试解释在温度较高时,(NH4)2SO3氧化速率下降的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与胶体性质无关的是( )
A.向豆浆中加入硫酸钙做豆腐
B.将植物油倒入水中用力搅拌形成油水混合物
C.利用丁达尔效应可以区别溶液与胶体
D.观看电影时,从放映机到银幕有明显的光路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.1mol·L-1HF溶液中加入0.1 mol CaCl2固体(不考虑溶液体积变化),则下列说法中错误的是
A. 原HF溶液c(H+)约为6×10-3mol·L-1
B. 加入 CaCl2后溶液中有CaF2沉淀产生
C. 加入CaCl2后溶液中的c(H+)浓度不变
D. 2HF(aq)+Ca2+(aq)=CaF2(s)+2H+(aq)的平衡常数为K=8.88×102
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.化学键只存在于分子之间B.化学键只存在于离子之间
C.形成化学键的微粒可以是原子也可以是离子D.化学键是相邻的分子之间强烈的相互作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年8月3日,中国科学家在《Nature》杂志发表论文,合成了一种代号为ICM-101的高能量密度材料。合成该高能物质的主要原料为草酰二肼,结构简式如图所示。下列有关草酰二肼的说法正确的是

A. 可由草酸(HOOC-COOH)和肼(H2N-NH2)发生酯化反应制备
B. 不能发生水解反应
C. 与联二脲(H2NCONHNHCONH2)互为同分异构体
D. 分子中最多有12个原子处于同一平面(已知NH3分子构型为三角锥)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.10 mol镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为( )
A. 3.2 g B. 4.0 g C. 4.2 g D. 4.6 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com