
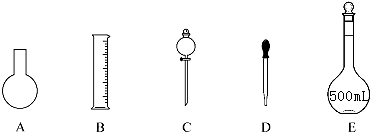
分析 (1)根据配制一定物质的量浓度的溶液的步骤确定所用仪器进行判断;
(2)容量瓶是配制一定体积准确浓度的标准溶液的定容仪器,不能用于量取溶液,也不能溶解、贮存溶液;
(3)依据n=c×V m=n×M计算氢氧化钠的质量,依据c=$\frac{n}{V}$分析实验操作对n和V的影响;
(4)先依据c=$\frac{1000ρω}{M}$计算浓硫酸的浓度,然后依据稀释前后溶质的物质的量保持不变计算所需浓硫酸的体积,根据需要浓硫酸的体积确定选用量筒的规格.
解答 解:(1)配制一定物质的量浓度的溶液需要的仪器有:托盘天平、量筒、药匙、烧杯、玻璃杯、500ml的容量瓶、胶头滴管,不需要的是圆底烧瓶、分液漏斗,
故答案为:A、C;烧杯、玻璃棒;
(2)容量瓶作为精密仪器不可用于储存和加热溶解固体、稀释液体,也不能测量除其规格以外容积的液体体积,只能用于配制一定物质的量浓度的溶液,故A正确、BCD错误,
故答案为:BCD;
(3)需要氢氧化钠的物质的量n=C×V=0.80mol•L-1 ×0.5L=0.4mol,质量为m=n×M=0.4mol×40g/mol=16.0g,
依据c=$\frac{n}{V}$:若容量瓶用蒸馏水洗涤后未干燥,对溶质的物质的量和溶液的体积不会造成影响,浓度无影响;
若还未等溶液冷却就定容了,则会导致溶液的体积偏小,浓度偏大,
故答案为:16.0;等于;大于;
(4)浓硫酸的浓度为c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸的体积为V则:18.4mol/L×V=0.40mol•L-1×0.5L,解得:V=0.0109L=10.9mL,应选择15mL的量筒,
故答案为:10.9;15.
点评 本题考查一定物质的量浓度溶液的方法,题目难度不大,明确配制原理是解题关键,注意容量瓶规格的选择和使用注意事项,试题侧重基础知识的考查,有利于提高学生的化学实验能力.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①和③ | C. | ①②③⑤ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断裂1 mol H2O中的化学键需要吸收925.6 KJ的能量 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H=-480.4 KJ•mol-1 | |
| C. | 2H2O(l)═2H2(g)+O2(g)△H=471.6 KJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-240.2KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 室温下,用pH试纸测定浓度为0.1mol•L-1 NaClO溶液的pH | |
| B. | 将4mL0.01mol•L-1 KSCN溶液与1mL0.01mol•L-1 FeCl3溶液充分混合,再继续加入KSCN溶液,溶液颜色加深,证明溶液中存在平衡::Fe3++3SCN-?Fe(SCN)3 | |
| C. | 将碱的稀溶液缓慢倒人酸的稀溶液中.所测反应后混合液温度值偏小 | |
| D. | 测定Na2SO3溶液与Na2CO3溶液的酸碱性,说明非金属性:S>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
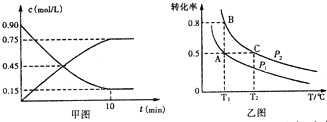
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
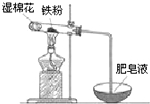 铝和铁是日常生活中用途广泛的金属.
铝和铁是日常生活中用途广泛的金属.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com