
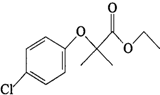
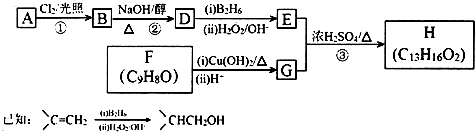
 )是临床上一种降脂抗血栓药物,它的一条合成路线如下:
)是临床上一种降脂抗血栓药物,它的一条合成路线如下: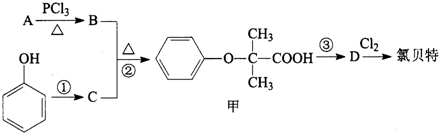
 .
.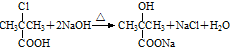 .
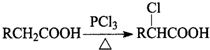
. 分析 A发生信息反应生成B,苯酚反应得到C,B与C发生信息反应生成甲,苯酚与氢氧化钠等反应生成C为苯酚钠,则B为ClC(CH3)2COOH,A为(CH3)2CHCOOH,由氯贝特的结构可知甲与乙醇反应生成D为 ,据此解答.
,据此解答.
解答 解:A发生信息反应生成B,苯酚反应得到C,B与C发生信息反应生成甲,苯酚与氢氧化钠等反应生成C为苯酚钠,则B为ClC(CH3)2COOH,A为(CH3)2CHCOOH,由氯贝特的结构可知甲与乙醇反应生成D为 .
.
(1)氯贝特的分子式为C12H15ClO3,A的结构简式为CH3)2CHCOOH,甲中含有的官能团有羧基、醚键,
故答案为:C12H15ClO3;CH3)2CHCOOH;羧基、醚键;
(2)反应①为苯酚转化为苯酚钠,可以入下列物质中的氢氧化钠、碳酸钠,不能与NaHCO3、CH3COONa反应,
故答案为:ab;
(3)反应②的反应类型为:取代反应,氯贝特分子中有5种化学环境不同的H原子,核磁共振氢谱有5组吸收峰,
故答案为:取代反应;5;
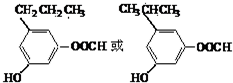
(4)甲有多种同分异构体,同时满足以下条件:①1,3,5-三取代苯;②属于酯类且既能与FeCl3溶液显紫色,又能发生银镜反应,含有酚羟基、醛基;③1mol同分异构体最多能与3molNaOH反应,结合②可知应含有酚羟基、甲酸与酚形成的酯基,故侧链为-OH、-CH2CH3、-OOCH,或侧链为-OH、-CH3、-OOCCH3,符合条件的同分异构体有: ,
,
故答案为:2; ;
;
(5)B与足量NaOH溶液反应的化学方程式为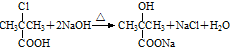 ,故答案为:
,故答案为: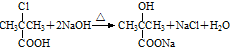 .
.
点评 本题考查有机物推断、官能团结构与性质、有机反应类型、同分异构体等,明确官能团及其性质关系是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
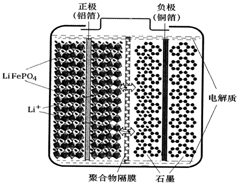 锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.
锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

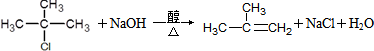 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
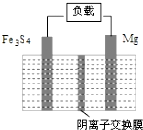 一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg$?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )
一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg$?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )| A. | 放电时,镁电极为负极 | |
| B. | 放电时,正极的电极反应式为Fe3S4+8e-=3Fe+4S2- | |
| C. | 充电时,阴极的电极反应式为MgS+2e-=Mg+S2- | |
| D. | 充电时,S2-从阴离子交换膜左侧向右侧迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
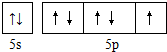 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
如何减少温室气体CO2的含量是科学家一直在探究的课题,最近中国科学技术大学的专家找到一种新型催化剂,可将CO2转化为液体燃料甲酸(CH2O2),下列说法中,不正确的是
A.地球上CO2含量上升的主要原因是植物的呼吸作用
B.CO2能吸收地面辐射,对地球有保温作用
C.CO2转化为甲酸的过程属于化学变化
D.这种新型催化剂在反应前后质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.观察Fe(OH)2 的生成 | B.中和滴定 | C.除去CO2气体中 的HCl气体 | D.制取并收集干燥 的氨气 |
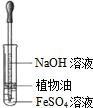 |  | 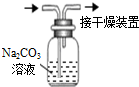 | 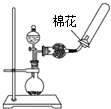 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com