
【题目】100mL 2mol/L 稀硫酸与1g锌粒反应,在一定温度下为了减缓反应的速率,而又不影响生成氢气的总量,可向反应物中加入
A.硫酸钠固体 B.硫酸铜固体
C.氯化钠溶液 D.硝酸钾溶液
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】下列装置合理且能达到实验目的的是

A. 实验室用装置①制取氨气
B. 装置②将化学能转化为电能
C. 装置③可用于分离沸点相差较大的互溶液体混合物
D. 装置④可用于Fe(OH)2的制取,并能防止Fe(OH)2被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是由周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如图1所示的关系,完成下列空白:
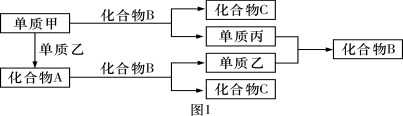
(1)向酚酞试液中加入化合物A的粉末,现象为 。
(2) 单质甲与化合物B反应的离子方程式为 。5.05 g单质甲—钾合金溶于200 mL水生成0.075 mol氢气,确定该合金的化学式为__ __。
(3)向20 mL某浓度的化合物C的溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1 mol/L盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图2图示两种情况。
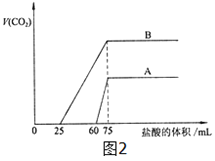
①由A确定滴加前60 mL的盐酸时,发生反应的离子方程式为 。
②由B表明,原溶液通入CO2气体后,所得溶液中的溶质的化学式为__ __。
③由A、B可知,两次实验通入的CO2的体积比为__ __。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有大量的H+和SO42-,则此溶液还能大量存在的离子组是
A.Na+、Fe2+、NO3-
B.Na+、Mg2+、NO3-
C.Cr2O72-、Ba2+、Cl-
D.K+、Na+、S2O32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在试管中做铁钉与稀硫酸反应的实验,发现反应速率较慢,下列措施:①给试管加热 ②加入铁粉 ③加入冰块④加入少量醋酸钠晶体 ⑤将稀硫酸换为浓硫酸,能加快反应速率的是
A.①②⑤ B.①② C.③④ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某2.0L硫酸溶液中含有1.0mol H2SO4.试计算:
(1)溶液中H2SO4的物质的量浓度;
(2)向上述溶液中加入足量的铁粉,产生气体的体积(标准状况);
(3)假设反应前后溶液体积不变,则所得溶液中Fe2+的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种常见的强氧化剂。实验室以精选铬铁矿(主要成分可表示为FeO.Cr2O3,还含有SiO2、Al2O3等杂质)为原料制备重铬酸钾晶体(K2Cr2O7,式量294)的流程如下:

请回答下列问题:
(1)操作1中发生的反应有:
4FeO·Cr2O3 + 8Na2CO3 + 7O2 = 8Na2CrO4 + 2Fe2O3 + 8CO2↑
Na2CO3 + Al2O3 = 2NaAlO2 + CO2↑ Na2CO3 + SiO2 = Na2SiO3 + CO2↑
该步骤在常温下的反应速率较慢,为使反应速率增大,可采取的措施是_____________________,__________________________。(写出两条)
(2)固体Y中主要含有 ______________。(填写化学式)
(3)酸化步骤使含铬物质发生了转化为_________,请写出离子反应方程式____________。
(4)操作4中的化学反应在溶液中能发生的可能理由是_________________,获得晶体的操作依次是:加入KCl固体,在水浴上加热浓缩至____________________,冷却结晶,抽滤、洗涤、干燥。
(5)通过下列实验可测定产品中重铬酸钾的质量分数:
称取重铬酸钾试样1.470g,用100mL容量瓶配制成溶液。移取25.00mL溶液于碘量瓶中,加入适量稀硫酸和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入一定量的水,加入淀粉指示剂,用0.1500mol/L Na2S2O3标准溶液滴定,共消耗标准液36.00mL。滴定时发生的反应的离子方程式为:I2 + 2S2O32- = 2I- + S4O62-则所测定产品中重铬酸钾的纯度为___________。
(6)有关上述实验过程中涉及的部分实验操作的描述,正确的是____________。
A.粗产品若要进一步提纯,可以采用重结晶的方法
B.配制溶液时,用托盘天平称取试样后,一般经溶解、转移(含洗涤)、定容等步骤,配制成100mL溶液
C.滴定时,当最后一滴标准溶液滴入时,溶液变为蓝色,且半分钟内不变色,可判断滴定终点
D.滴定终点时俯视读数,测定结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到1 mol ·L-1 HC1溶液里,待合金完全溶解后,再往溶液里加入 1 mol L-1 NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如右图所示。下列说法中错误的是( )
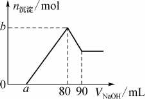
A.HC1溶液的体积为80 mL B.a的取值范围为0≤a<50
C.当a值为30时,b值为0.01 D.当a值为10时,b值为0.03
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程合乎实际并用于工业生产的是( )
A. 钠在氯气中燃烧制氯化钠
B. 氯化铵与氢氧化钙共热制氨气
C. 浓盐酸与二氧化锰共热制氯气
D. 氯气与石灰乳反应制漂白粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com