
| A. | 胶粒可以透过滤纸,不能透过半透膜 | |
| B. | 采用喷雾型药剂形成一定大小的液珠,可有效提高药物疗效 | |
| C. | 冶金工业的矿粒除尘利用了丁达尔效应 | |
| D. | 空气中的雾压现象体现了胶体的存在 |
分析 A.胶体微粒直径在1-100nm,胶体粒子不能透过半透膜;
B.采用喷雾型药剂形成一定大小的液珠可以增大接触面积提高药效;
C.冶金工业的矿粒除尘是利用胶体的电泳性质除尘;
D.空气中的雾压现象是胶体形成的现象.
解答 解:A.胶体粒子不能透过半透膜,但能透过滤纸,故A正确;
B.采用喷雾型药剂形成一定大小的液珠可以增大接触面积,可有效提高药物疗效,故B正确;
C.冶金工业的矿粒除尘利用了电泳现象,通电使灰尘向某一个电解聚集,故C错误;
D.空气中的雾压现象是胶体形成的现象,体现了胶体的存在,故D正确;
故选C.
点评 本题考查了胶体的成分、性质及其性质的应用,主要是胶体电泳现象、微粒直径大小的判断,掌握基础是解题关键,题目较简单.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 如果某化合物只含共价键,则其一定是共价化合物 | |
| B. | H2O2是由极性共价键和非极性共价键构成的非极性分子 | |
| C. | 两种酸溶液充分反应后的体系不可能为中性 | |
| D. | 碳、氮形成的氢化物常温下都是气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
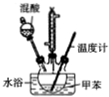 2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质
2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质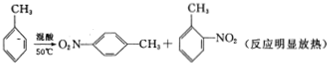
| 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 2-硝基甲苯 | 137 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
| 4-硝基甲苯 | 137 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
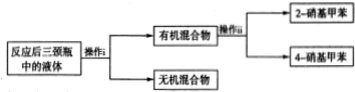
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
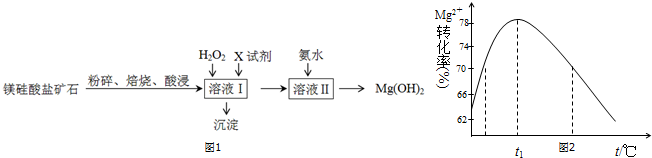
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的晶体,一定是原子晶体 | |
| B. | 离子晶体中,一定存在金属元素和非金属元素 | |
| C. | 同时含有离子键和共价键的化合物,既可能是离子化合物,也可能是共价化合物 | |
| D. | 在共价化合物中一定存在共价键,但含有共价键的不一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
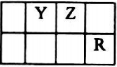 己知X、Y、Z、Q、R是原子序数依次增大的短周期元素,X和Q位于同主族,Y、Z、R在元素周期表中的相对位置如图所示,其中Q与R属于同周期.且R的单质常温下是一种黄绿色气体,X2Z2分子和R-离子具有相同的电子数,请回答:
己知X、Y、Z、Q、R是原子序数依次增大的短周期元素,X和Q位于同主族,Y、Z、R在元素周期表中的相对位置如图所示,其中Q与R属于同周期.且R的单质常温下是一种黄绿色气体,X2Z2分子和R-离子具有相同的电子数,请回答: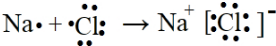 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 研制乙醇汽油技术,能够降低机动车尾气中有害气体的排放 | |
| B. | 联合制碱法生产纯碱时,在饱和食盐水中先通入二氧化碳,再通入氨气 | |
| C. | 接触法制备硫酸的过程中,在吸收塔内是用大量的水吸收三氧化硫 | |
| D. | 工业上通过电解熔融氧化铝制备金属铝时,常常加入冰晶石作助熔剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度降低 | |
| B. | SO2和FeSO4溶液使酸性高锰酸钾的紫色褪去 | |
| C. | 漂白粉、活性炭、Na2O2都能使红墨水褪色 | |
| D. | 亚硫酸钠溶液和氯化铝溶液在空气中蒸干不能得到对应的溶质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
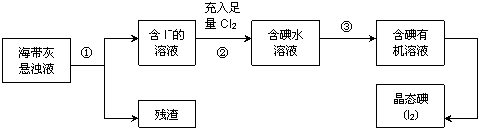
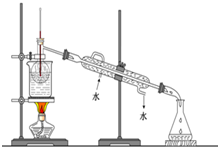
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com