
【题目】下列不属于短周期元素的是
A.HB.KC.PD.He
科目:高中化学 来源: 题型:
【题目】在Fe(NO3)3和Cu(NO3)2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示,则该溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为

A.3∶1 B.1∶2 C.2∶1 D.1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+I2(g)2HI(g)△H=﹣14.9kJ/mol.某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示.甲中反应达到平衡时,测得c(H2)=0.008mol/L. 下列判断正确的( )
起始浓度 | c(H2)/mol/L | c(I2)/mol/L | c(HI)/mol/L |
甲 | 0.01 | 0.01 | 0 |
乙 | 0.02 | 0.02 | 0 |
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~Q10种有机物的转化关系如图所示,其中部分反应的条件未给出.已知:G的氧化产物能发生银镜反应.等物质的量的A和J分别与足量的NaHCO3溶液反应,产生CO2(相同状况)的体积比为1:2.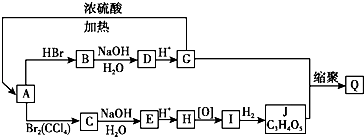
(1)A的结构简式为;H的结构简式为;J的结构简式为 .
(2)写出下列化学反应的反应类型A→C反应;C→E反应.
(3)写出下列转化的化学方程式B→D;G→A .
(4)与G具有相同官能团的物质的结构简式还有; G的另一种同分异构体可发生银镜反应,其核磁共振氢谱中有5个峰,其结构简式为 .
(5)Q的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.硫酸与氢氧化钡溶液反应:Ba2++SO ![]() ═BaSO4↓
═BaSO4↓
B.铝和氢氧化钠溶液反应:Al+OH﹣+3H2O═Al(OH) ![]() +H2↑
+H2↑
C.向次氯酸钠溶液中通入足量SO2 气体:ClO﹣+SO2+H2O═HClO+HSO ![]()
D.向沸水中逐滴加入FeCl3饱和溶液:Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组在实验室制备氨气,并进行有关氨气的性质探究.
(1)该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气.①应该选用的仪器及装置有(填字母) .
②生石灰与氯化铵反应生成氨气的化学方程式为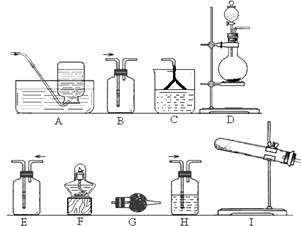
(2)该小组同学设计如图所示装置探究氨气的还原性.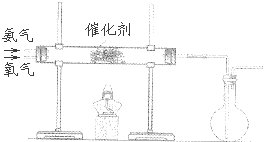
在上述过程会同时发生多个反应,写出其中属于置换反应的化学方程式 . 若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为 .
(3)该小组同学以氨气和二氧化碳为原料制备碳酸氢铵.①甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳.合适的方案是(填“甲”或“乙”),原因是 .
②检验产物中有NH ![]() 的方法为 .
的方法为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系的表述中,正确的是( )
A.0.1mol?L﹣1NaHSO4溶液中:c(Na+)+c(H+)=c(SO ![]() )+c(OH﹣)
)+c(OH﹣)
B.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1
C.pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)不相等
D.0.1mol?L﹣1NaHCO3溶液中:c(Na+)>c(HCO ![]() )>c(CO
)>c(CO ![]() )>c(H2CO3)
)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.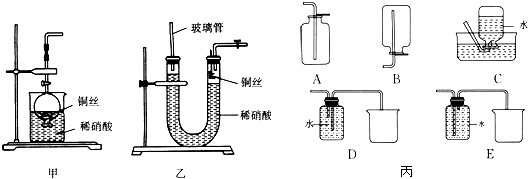
(1)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示.①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是(填字母).
A.铁B.铝C.铂D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是(填化学方程式).
(2)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO.反应开始后,可以在U形管右端观察到无色的NO气体.①长玻璃管的作用是 .
②让反应停止的操作方法及原因是 .
(3)以下收集NO气体的装置(图丙),合理的是(填选项代号).
(4)假设实验中12.8 g Cu全部溶解,需要通入标况下O2才能使NO全部溶于水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),流程如下:
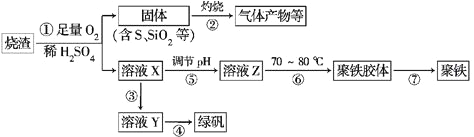
(1)将过程②中产生的气体通入下列溶液中,溶液会褪色的是________(填选项序号)。
a.品红溶液 b.紫色石蕊溶液 c.酸性KMnO4溶液 d.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为______________________
(3)过程③中,需加入的物质是____________;反应的化学方程式为_____________________
如何检验溶液Y中存在Fe2+?__________________________________________
(4)在实验室里,完成过程④的操作是____________(填操作名称),需要使用酒精灯、三脚架、坩埚钳等,还需要的陶瓷仪器有___________________________。
(5)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验:①用分析天平称取2.700 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁的主要成分为[Fe(OH)SO4]n,则聚铁样品中铁元素的质量分数为________。(假设杂质中不含铁元素和硫元素)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com