
下列物质的水溶液能导电,但属于非电解质的是()
A. HCl B. Cl2 C. NaHCO3 D. CO2
考点: 电解质与非电解质.
专题: 电离平衡与溶液的pH专题.
分析: 电解质是指在水溶液或熔化状态下能导电的化合物,而非电解质是指在水溶液和熔化状态下都不能导电的化合物,据此进行判断.
解答: 解:A.氯化氢在溶液中能够电离出氢离子和氯离子,溶液导电,氯化氢属于电解质,故A错误;
B.氯气其水溶液导电,但不是物质本身导电,氯气的成分是单质,不是非电解质,故B错误;
C.碳酸氢钠溶液能够导电,碳酸氢钠属于电解质,能够电离出钠离子和碳酸氢根离子,故C错误;
D.二氧化碳溶于水生成碳酸,碳酸是电解质,电离出离子使能够导电,但是溶液导电的原因不是二氧化碳不是电离的离子,所以二氧化碳不属于电解质,属于非电解质,故D正确;
故选D.
点评: 本题考查电解质和非电解质,学生应明确电解质和非电解质都是化合物,并明确判断电解质时发生电离的为化合物本身来分析解答即可,题目难度不大.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
实验中的下列操作正确的是()
A. 取用Na2CO3溶液时,发现取量过多,为了不浪费,把过量的试剂倒回试剂瓶中
B. Ba(NO3)2可溶于水,因此可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道
C. 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干
D. 稀释浓硫酸时,应该将浓硫酸缓缓注入水中,并不断搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
用20g烧碱配制成500mL其物质的量浓度为1mol/L,从中取出1mL,其物质的量浓度为 mol/L;含溶 质 g.若将这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为 mol/L,其中含Na+ .
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是()
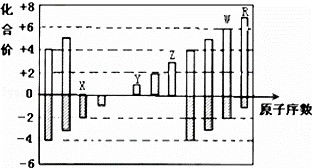
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R<W
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. CO的摩尔质量为28
B. 常温常压下,NA个氢原子与NA 个氮气的质量比为1:14
C. 32克O2所含原子数目为2NA
D. 常温常压下,1molCO分子所占体积是22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
根据反应式:(1)2Fe3++2I﹣=2Fe2++I2,(2)Br2+2Fe2+=2Fe3++2Br﹣,判断下列离子的还原性由强到弱的顺序是()
A. Br﹣、Fe2+、I﹣ B. I﹣、Fe2+、Br﹣ C. Br﹣、I﹣、Fe2+ D. Fe2+、I﹣、Br﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
A﹣H分别是中学化学中的常见物质,它们之间有下图所示关系(反应中所需要和所生成的水均没有列出),已知B、H为常见的金属单质,A、C均为气体单质且A气体的颜色为黄绿色,F的水溶液为蓝色,B、D、G、E中均含同一种元素.请回答:
(1)A、B、G、H分别是什么物质?(写物质名称)
A ,B铁,G ,H
(2)写出D→F反应的离子方程式: .
(3)写出G和稀盐酸反应的化学方程式: .
(4)2molB与足量的A完全反应生成D时所转移的电子为 mol.
(5)如何检验D溶液中的阳离子? .

查看答案和解析>>
科目:高中化学 来源: 题型:
人们常将在同一原子轨道上运动的,自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”.以下有关主族元素原子的“未成对电子”的说法,错误的是( )
|
| A. | 核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子” |
|
| B. | 核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子” |
|
| C. | 核外电子数为偶数的基态原子,其原子轨道中可能含有“未成对电子” |
|
| D. | 核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com