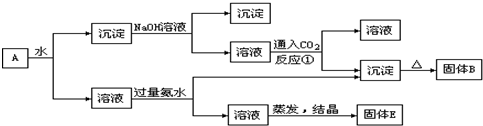
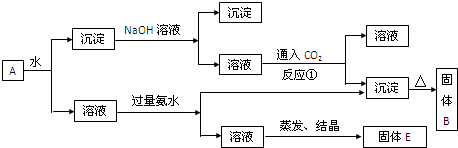
解:KAl(SO
4)
2溶于水,Al
2O
3和Fe
2O
3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO
4)
2,沉淀是Al
2O
3和Fe
2O
3;
(1)、向沉淀中加NaOH溶液,Fe
2O
3不反应,Al
2O
3可与NaOH溶液反应生成NaAlO
2,向NaAlO
2溶液中通入CO
2可得Al(OH)
3沉淀和碳酸钠(或者碳酸氢钠,取决于CO
2的量),Al(OH)
3受热分解2Al(OH)
3
Al
2O
3+3H
2O,生成Al
2O
3;
故答案为:Al
2O
3 (2)、向溶液中加过量氨水,溶液与过量氨水反应,Al
3++3NH
3.H
2O=3NH
4++Al(OH)
3↓,Al
3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K
2SO
4 和(NH
4)
2SO
4,经过蒸发、结晶,得到的是K
2SO
4 和(NH
4)
2SO
4.
故答案为:K
2SO
4;(NH
4)
2SO
4 (3)、向NaAlO
2溶液中通入CO
2可得Al(OH)3沉淀和Na
2CO
3(或者NaHCO
3,取决于CO
2的量)
反应①CO
2不足时,生成Al(OH)3沉淀和碳酸钠,离子方程式为:2AlO
2-+CO
2+3H
2O=CO
32-+2Al(OH)
3↓;
CO
2过量时,生成Al(OH)3沉淀和碳酸氢钠,离子方程式为:AlO
2-+CO
2+2H
2O=HCO
3-+Al(OH)
3↓.
故答案为:2AlO
2-+CO
2+3H
2O=CO
32-+2Al(OH)
3↓或AlO
2-+CO
2+2H
2O=HCO
3-+Al(OH)
3↓
分析:KAl(SO
4)
2溶于水,Al
2O
3和Fe
2O
3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO
4)
2,沉淀是Al
2O
3和Fe
2O
3;
(1)、向沉淀中加NaOH溶液,Fe
2O
3不反应,Al
2O
3可与NaOH溶液反应生成NaAlO
2,向NaAlO
2溶液中通入CO
2可得Al(OH)
3沉淀,Al(OH)
3受热分解生成Al
2O
3;
(2)、向溶液中加过量氨水,溶液与过量氨水反应,Al
3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K
2SO
4 和
(NH
4)
2SO
4,经过蒸发、结晶,得到的是K
2SO
4 和(NH
4)
2SO
4.
(3)、向NaAlO
2溶液中通入CO
2可得Al(OH)
3沉淀和碳酸钠(或者碳酸氢钠,取决于CO
2的量).
点评:以框图形式考查物质的性质,具有一定的综合性,本题的关键在于Al
2O
3具有两性

 Al2O3+3H2O,生成Al2O3;
Al2O3+3H2O,生成Al2O3;