
| A. | AlO2-、Na+、HCO3-、K+ | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | K+、Al3+、Cl-、CO32- | D. | Cu2+、NH4+、I-、Cl- |
分析 A.偏铝酸根离子与碳酸氢根反应生成氢氧化铝沉淀和碳酸根离子;
B.四种离子之间不发生反应;
C.铝离子与碳酸根离子发生双水解反应;
D.四种离子之间不发生反应.
解答 解:A.AlO2-、HCO3-之间反应生成氢氧化铝和碳酸根离子,该反应不属于水解反应,故A错误;
B.NH4+、HCO3-、Cl-、K+之间不反应,不满足条件,故B错误;
C.Al3+、CO32-之间发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,满足条件,故C正确;
D.Cu2+、NH4+、I-、Cl-之间不反应,能够大量共存,不满足条件,故D错误;
故选C.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度中等,明确离子反应发生条件为解答关键,注意掌握离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;本题中注意题干要求“因水解而不能够大量共存”,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 甲乙丙丁 | B. | 丁乙丙甲 | C. | 丙乙丁甲 | D. | 乙丁丙甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的质量分数为7.8% | B. | 溶液中溶质的质量大于7.8g | ||
| C. | 溶液中水的质量等于92.2g | D. | 溶液的质量等于100g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键 | H-H | Br-Br | I-I | H-CL | H-CL | H-I | H-Br |
| 键能 | 436 | 193 | 243 | 431 | 431 | 298 | 366 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
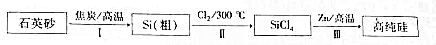
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com