
分析 根据n=$\frac{V}{{V}_{m}}$计算HCl物质的量,根据m=nM计算HCl质量,溶液质量=HCl质量+水的质量,根据V=$\frac{m}{ρ}$计算溶液体积,再根据c=$\frac{n}{V}$计算溶液物质的量浓度.
解答 解:标况下224L HCl物质的量为$\frac{224L}{22.4L/mol}$=10mol,HCl质量=10mol×36.5g/mol=265g,溶液质量=365g+635mL×1g/mL=1000g,则溶液体积=$\frac{1000g}{1180g/L}$=$\frac{100}{118}$L,溶液物质的量浓度=$\frac{10mol}{\frac{100}{118}L}$=11.8mol/L,
故答案为:11.8mol/L.
点评 本题考查物质的量浓度计算,难度不大,关键是计算溶液体积,注意对物质的量浓度定义式理解.


科目:高中化学 来源: 题型:填空题
| 元素 | 相关信息 |
| A | 简单氢化物能与其最高价含氧酸反应生成盐 |
| B | 原子最外层电子数是其电子层数的3倍 |
| C | 周期表中非金属性最强的元素 |
| D | 与C位于同主族,且都为短周期元素 |
 .X常用作漂白剂,也用于柠檬等水果的熏蒸处理.已知化合物X中,A显负价,D显正价,则该化合物与水反应的化学方程式为NCl3+4H2O=NH3.H2O+3HClO.
.X常用作漂白剂,也用于柠檬等水果的熏蒸处理.已知化合物X中,A显负价,D显正价,则该化合物与水反应的化学方程式为NCl3+4H2O=NH3.H2O+3HClO.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16.7% | B. | 50% | C. | 66.7% | D. | 83.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向该溶液中加入酸化的Ba(NO3)2溶液出现白色沉淀,说明溶液中一定有SO42- | |
| B. | 向该溶液中加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO42- | |
| C. | 向该溶液中加入足量HCl,无现象,再加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO42- | |
| D. | 向该溶液中加入BaCl2溶液,产生白色沉淀,再加入HCl沉淀不溶解,说明该溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
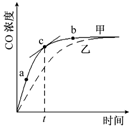 已知反应Al2O3(s)+3C(s)+N2(g)?2AlN(s)+3CO(g)在温度、容积恒定的密闭容器中进行,其中CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是( )
已知反应Al2O3(s)+3C(s)+N2(g)?2AlN(s)+3CO(g)在温度、容积恒定的密闭容器中进行,其中CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是( )| A. | 从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率 | |
| B. | c点切线的斜率表示该化学反应在t时刻的瞬时速率 | |
| C. | 在不同时刻都存在关系:3v(N2)=v(CO) | |
| D. | 维持温度、容积不变,若减少N2的物质的量进行反应,曲线甲将转变为曲线乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn2++2OH-=Zn(OH)2↓ ZnCO3+2NaOH=Zn(OH)2↓+Na2CO3 | |
| B. | Ba2++SO42-=BaSO4↓ Ba(OH)2+H2SO4=BaSO↓+2H2O | |
| C. | Ag++Cl-=AgCl↓ AgNO3+NaCl=AgCl↓+NaNO3 | |
| D. | Cu+2Ag+=Cu2++2Ag↓ Cu+2AgCl=2Ag+CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
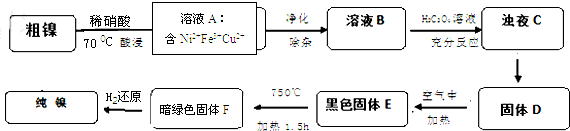
| 物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS |
| Ksp | 8.8×10-38 | 2.2×10-20 | 5.48×10-18 | 3.2×1018 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 锌与盐酸的反应:Zn+2H++2Cl-═Zn2++2Cl-+H2↑ | |
| D. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com