
��ҵ���ڴ��������¿�����CO�ϳɼ״���CO(g)+2H2(g) CH3OH(g)��ͼ1��ʾ��Ӧ�����������ı仯�����
CH3OH(g)��ͼ1��ʾ��Ӧ�����������ı仯�����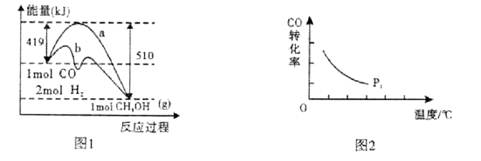
��ش��������⣺
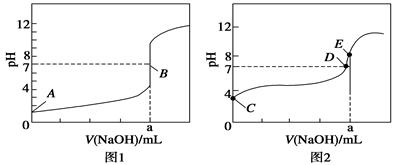
��1����ͼI�У�����______(�a����b������ʾʹ���˴������÷�Ӧ����______(����ȡ����ȡ�����Ӧ��
��2��Ϊ̽����������Ժϳɼ״���ѧ��Ӧ���ʵ�Ӱ����ɣ�ij�Ƽ��������������������ʵ�飬�������������˱��У��벹��������
| ʵ���� | T/�� | ��ʼŨ��/mol?L��1 | ������������ �ȱ����/m2?g��1 | |
| CO | H2 | |||
| �� | 280 | 1.20��10��3 | 5.80��10��3 | 82 |
| �� | 280 | 1.20��10��3 | 5.80��10��3 | 124 |
| �� | 350 | | | 124 |
��15�֣�
��1��b��2�֣� ���ȣ�2�֣�
��2��1.20��10��3��1�֣� 5.80��10��3��1�֣� ̽�������������ıȱ������ͬʱ�Ժϳɼ״���ѧ��Ӧ���ʵ�Ӱ����ɣ�2�֣�����������Ҳ���֣�
��3��CO��ת�������¶ȵ����߶����ͣ�2�֣�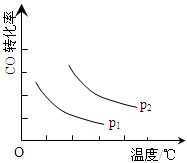
��4��H2 ��2e��+2OH��=2H2O��3�֣�
���������������1����ͼ1�������ܽ��ͷ�Ӧ�Ļ�ܣ�����a���������淴Ӧ�Ļ�ܸ�������b������b��ʾʹ���˴�����a��ʾδʹ�ô��������ȷ�Ӧ�з�Ӧ�����������������������������ȷ�Ӧ�з�Ӧ��������������������������ͼ��1molCO��2molH2������������1molCH3OH(g)�������������Ը÷�Ӧ�Ƿ��ȷ�Ӧ����H=��91kJ/mol����2��ֻ�ı�һ����������̽�������ܸ�����������Ӱ�컯ѧ��Ӧ���ʵĹ��ɣ��������ʵ��Ļ���ԭ��ʵ��ڢ۵��¶ȷֱ���280�桢350�棬��CO��H2����ʼŨ�ȡ������������ıȱ������Ӧ����ͬ������CO��H2����ʼŨ�ȷֱ�Ϊ1.20��10��3mol/L��5.80��10��3mol/L��ʵ��٢ڵ��¶ȡ�CO��H2����ʼŨ�ȶ���ͬ�������������ıȱ�����ֱ�Ϊ82m2/g��124m2/g����������ʵ���Ŀ����̽�������������ıȱ������ͬʱ�Ժϳɼ״���ѧ��Ӧ���ʵ�Ӱ����ɣ���3����ͼ2����������ֱ��ʾ�¶ȡ�COת���ʣ���ѹǿ����ʱ�����߱�ʾCO��ת�������¶����߶����ͣ����¶Ȳ���ʱ����������Ӧ�����������С�ķ�Ӧ������ѹǿƽ��������Ӧ�����ƶ���CO��ƽ��ת���������ɴ��ƶ�p2ʱ���߸���p1ʱ���ߣ���4����ӦCO(g)+2H2(g) CH3OH(g)�г�̼Ԫ����+2��Ϊ��2����Ԫ����0��Ϊ+1��˵��CO�õ����ӣ�������ԭ��Ӧ����H2ʧȥ���ӣ�����������Ӧ����˸�������Ҫ��Ӧ��Ͳ�����������ˮ���ɴ��ȵó�H2 ��2e����H2O������������ֻ��������������ʹ���ҵ���غ㣬��H2 ��2e��+2OH����H2O���缫��Ӧʽ��ѭ�����غ㶨�ɣ������⡢��ԭ�Ӹ����غ㣬��õ�ظ�����ӦʽΪH2 ��2e��+2OH��=2H2O��
CH3OH(g)�г�̼Ԫ����+2��Ϊ��2����Ԫ����0��Ϊ+1��˵��CO�õ����ӣ�������ԭ��Ӧ����H2ʧȥ���ӣ�����������Ӧ����˸�������Ҫ��Ӧ��Ͳ�����������ˮ���ɴ��ȵó�H2 ��2e����H2O������������ֻ��������������ʹ���ҵ���غ㣬��H2 ��2e��+2OH����H2O���缫��Ӧʽ��ѭ�����غ㶨�ɣ������⡢��ԭ�Ӹ����غ㣬��õ�ظ�����ӦʽΪH2 ��2e��+2OH��=2H2O��
���㣺���黯ѧ��Ӧԭ�����漰��ѧ��Ӧ��������ϵ�����仯ͼ���������Ĺ�ϵ�����ȷ�Ӧ�����ȷ�Ӧ�����Ʊ������̽��ʵ�鷽�����Ա�ʵ���Ŀ�ġ��¶Ⱥ�ѹǿ��ƽ���ƶ���Ӱ����ɡ�������Ӧʽ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ʵʩ�Լ�����Դ�˷Ѻͽ��ͷ����ŷ�Ϊ�������ݵĽ��ܼ������ߣ���Ӧ��ȫ���������⡢������Դ��Լ�͡������Ѻ������ı�Ȼѡ������ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����������ѧ֪ʶ������������⣺
����֪ij��Ӧ��ƽ�����ʽΪ��
������Ӧ�Ļ�ѧ��Ӧ����ʽΪ��
������ˮú���ϳɶ����ѵ�������Ӧ���£�
��2H2��g��+CO��g�� CH3OH��g������H=��90.8kJ��mol
CH3OH��g������H=��90.8kJ��mol
��2CH3OH��g�� CH3OCH3��g��+H2O��g������H=��23.5kJ��mol
CH3OCH3��g��+H2O��g������H=��23.5kJ��mol
��CO��g��+H2O��g�� CO2��g��+H2��g������H=��41.3kJ��mol
CO2��g��+H2��g������H=��41.3kJ��mol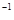
�ܷ�Ӧ��3H2��g��+3CO��g�� CH3OCH3��g��+CO2��g���Ħ�H=__________
CH3OCH3��g��+CO2��g���Ħ�H=__________
(3)ú����ͨ��ͨ���о���ͬ�¶���ƽ�ⳣ���Խ������ʵ�����⡣��֪�������һ����̼��ˮ�������뷴Ӧ��ʱ���ᷢ�����·�Ӧ��CO��g��+H2O��g�� H2��g��+CO2��g�����÷�Ӧƽ�ⳣ�����¶ȵı仯���±���ʾ��
H2��g��+CO2��g�����÷�Ӧƽ�ⳣ�����¶ȵı仯���±���ʾ��
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
 2NO2��g����H>0�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ���ǡ�
2NO2��g����H>0�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ���ǡ�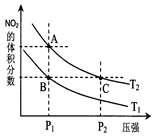
 CH3OH(g)+H2O(g)��H=��49.0kJ��mol��1�������¶ȡ��ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������¡�����˵����ȷ����
CH3OH(g)+H2O(g)��H=��49.0kJ��mol��1�������¶ȡ��ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������¡�����˵����ȷ����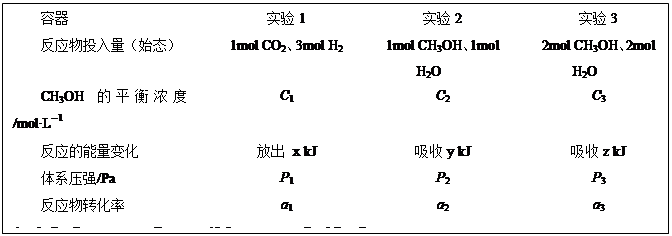
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1��ҽ���ϳ���Ũ��Ϊ75%��ij�л���ˮ��Һ��Ƥ������Һ�����л���Ľṹ��ʽ�� ��
��2��һ�������£�0.1mol������������Ӧ�������������壬�ų�31.67kJ������д���˷�Ӧ���Ȼ�ѧ����ʽ�� ��
��3�����й���X�����ܺ���Cu��SiO2��KNO3��NH4Cl�е�һ�ֻ��֡�Ϊ��̽����ɷ֣�ijѧϰС��ȡ����Ʒ��������ʵ�飨���ֲ�������ȥ����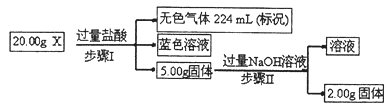
�ٲ���I�з�����Ӧ�����ӷ���ʽΪ ��
��20.00gX��Cu����������Ϊ ��
��Ϊ��һ��ȷ������X����ɣ������£�ѧϰС����ȡ����X��ˮ����ֽ������ˣ������Һ��pH��7�������ж�һ����NH4Cl�������� ��
��4����ҵ�ϳ��õ�����������HI����ģ��ʵ����ͼ��д�������ĵ缫��Ӧʽ�� ��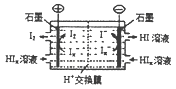
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��¯������ұ��������Ҫ��������������Ҫ��ӦΪ��
Fe2O3��s��+3CO��g�� 2Fe��s��+3CO2��g�� ��H= ��28��5 kJ����mol��1
2Fe��s��+3CO2��g�� ��H= ��28��5 kJ����mol��1
��1����֪��C��ʯī��+CO2��g�� 2CO��g�� ��H=" +" 172��5 kJ��mol��1
2CO��g�� ��H=" +" 172��5 kJ��mol��1
��Ӧ��Fe2O3��S�� +3C��ʯī�� 2Fe��s��+3CO��g�� ��H= kJ��mol��1
2Fe��s��+3CO��g�� ��H= kJ��mol��1
��2��ұ������Ӧ Fe2O3��s��+3CO��g�� 2Fe��s��+3CO2��g�� ��H=��28��5 kJ��mol��1��ƽ�ⳣ������ʽK= ���¶Ƚ��ͺ�Kֵ ��������������䡱��С������
2Fe��s��+3CO2��g�� ��H=��28��5 kJ��mol��1��ƽ�ⳣ������ʽK= ���¶Ƚ��ͺ�Kֵ ��������������䡱��С������
��3����ToCʱ,�÷�Ӧ��ƽ�ⳣ��K=27,��1L�����ܱ�����������,�ֱ��±���ʾ��������,��Ӧ����һ��ʱ���ﵽƽ��.
| | Fe2 O3 | CO | Fe | CO2 |
| ������ | 1��0 mol | 1��0 mol | 1��0 mol | 1��0 mol |
| ������ | 1��0 mol | 2��0 mol | 1��0 mol | 1��0 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���ǵ����Ϻ����ḻ��һ��Ԫ�أ���Ԫ�صĵ��ʺͻ������ڹ�ũҵ����������������Ҫ��;��
��1���������������仯ʾ��ͼ��
д��CO��NO2��Ӧ����NO��CO2���Ȼ�ѧ����ʽ
��2���ڹ̶�������ܱ������У��������»�ѧ��Ӧ��N2(g)+3H2(g)  2NH3 (g) ��H<0��
2NH3 (g) ��H<0��
��ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±������ж�K1 K2���>������=����<����
| T /K | 298 | 398 |
| ƽ�ⳣ��K | K1 | K2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ϳɰ���ҵ�Թ���������Ҫ���壬�������ᡢ�ϳ���ά�Լ�Ⱦ�ϵ�
��1����֪ijЩ��ѧ���ļ����������±���
| ��ѧ�� | N��N | H��H | N��H |
| ����kJ��mol��1 | 946 | 436 | 390 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ����NH3Ϊԭ�Ͼ���һϵ�з�Ӧ���Եõ�HNO3��
��1����ҵ��NH3�Ĵ�������Ӧ����ʽΪ ��Ϊ�˾����ܶ��ʵ��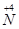 ��
��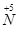 ��ת�����������һ�������Խ��� ��
��ת�����������һ�������Խ��� ��
��2������ҵ����NO��CO��ϣ�����Ԫ����ת�����������£�2CO+2NO 2CO2+N2��
2CO2+N2��
��֪��
CO(g)+ 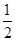 O2(g)=CO2(g) ��H=-283.0kJ��mol-1
O2(g)=CO2(g) ��H=-283.0kJ��mol-1
N2(g)+O2(g)=2NO(g) ��H=+180.0kJ��mol-1
��Ԫ����ת�����з�����Ӧ���Ȼ�ѧ����ʽΪ ��
Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�Ȳ������ݼ�¼���£�
| ʱ��/s | 0 | 2 | 3 | 4 |
| c(NO)/mol��L-1 | 1.00��10-3 | 1.50��10-4 | 1.00��10-4 | 1.00��10-4 |
 C(CO)/mol��L-1 C(CO)/mol��L-1 | |  |  2.70��10-3 2.70��10-3 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��12�֣� (1)��֪������1 mol Br2(l)��Ҫ���յ�����Ϊ 30 kJ����������������±���
| ���� | H2(g) | Br2(g) | HBr(g) |
| 1 mol�����л�ѧ������ʱ��Ҫ���յ�����/kJ | 436 | 200 | 369 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
I����¯������ұ��������Ҫ��������������Ҫ��ӦΪ��
Fe2O3(s) + 3CO(g) 2Fe(s)+3CO2(g) ��H
2Fe(s)+3CO2(g) ��H
��1����֪����Fe2O3(s) + 3C(ʯī)="2Fe(s)" + 3CO(g) ��H1
��C(ʯī��+ CO2(g) = 2CO(g) ��H2
���H___________________(�ú���H1 ����H2�Ĵ���ʽ��ʾ)��
��2����¯������Ӧ��ƽ�ⳣ������ʽK=____________________________��
��3����ij�¶�ʱ���÷�Ӧ��ƽ�ⳣ��K=64����2L�����ܱ����������У��ֱ��±���ʾ�������ʣ���Ӧ����һ��ʱ���ﵽƽ�⡣
| | Fe2O3 | CO | Fe | CO2 |
| ��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| ��/mol | 1.0 | 1.5 | 1.0 | 1.0 |
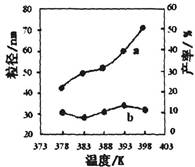
| ��� | �¶�/K | ��Ӧʱ��/h | ��Ӧ�����ʵ������ | ʵ��Ŀ�� |
| �� | 378 | 4 | 3��1 | ʵ��ں͢�̽��________ ______________________ ʵ��ں�__________̽�� ��Ӧʱ��Բ��ʵ�Ӱ�졣 |
| �� | 378 | 4 | 4��1 | |
| �� | 378 | 3 | _______ | |
| �� | 398 | 4 | 4��1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com