
| A. | 原电池的电极一定要由两种不同的金属组成 | |
| B. | 原电池的负极得电子,发生还原反应 | |
| C. | 原电池工作时,其正极不断产生电子并经外电路流向负极 | |
| D. | 原电池能将化学能转化为电能 |
分析 A.原电池的两极中,一极为较活泼金属,另一极可以为石墨棒;
B.原电池的负极失去电子被氧化,发生氧化反应;
C.原电池中电子由负极经过外电路流向正极;
D.原电池是将化学能转化成电能的装置.
解答 解:A.原电池的电极不一定是由两种不同的金属组成,可以一极为金属,另一极为碳棒,故A错误;
B.原电池的负极失去电子发生氧化反应,正极得电子发生还原反应,故B错误;
C.原电池工作时,其负极不断产生电子并经外电路流向正极,故C错误;
D.原电池工作过程中,是将化学能转化成电能,故D正确;
故选D.
点评 本题考查了原电池工作原理,题目难度不大,明确原电池两极的判断方法为解答关键,注意掌握原电池工作原理,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 将2molSO3气体通入一密闭容器中,反应达平衡后吸收QkJ热量,则该反应的热化学方程式为:2SO3(g)?2SO2(g)+O2(g)△H=+Q kJ/mol | |
| B. | 向20mL0.5mol•L-1FeBr2溶液中通入224mL Cl2(标准状况):2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 以金属银为阳极电解饱和硫酸铜溶液 Cu2++2H2O═2Cu+O2↑+4H+ | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液至恰好使SO42-完全沉淀::2Ba2++Al3++2SO42-+4OH-═2H2O+2BaSO4↓+AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为1:2:3 | |
| B. | 150 mL 1 mol•L-1的氯化钾溶液中的c(Cl-)与50 mL 1 mol•L-1的氯化铝溶液中的c(Cl-)相等 | |
| C. | 20℃时,饱和KCl溶液的密度为1.174 g•cm-3,物质的量浓度为4.0 mol•L-1,则此溶液中KCl的质量分数为$\frac{74.5×4.0}{1.174×1000}$×100% | |
| D. | 20℃时,100 g水可溶解34.2 g KCl,此时KCl饱和溶液的质量分数为34.2% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=12溶液中:Na+、Ca2+、HCO3-、ClO- | |
| B. | 在能使石蕊变红的溶液中:Mg2+、K+、Br-、SO4 2- | |
| C. | 在0.1mol•L-1的NaHCO3 溶液中:K+、Al3+、I-、Cl- | |
| D. | 在与Al 反应能放出H2 的溶液中:Fe2+、K+、NO3-、SO4 2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 | |
| B. | 常温下,铜片放入浓硫酸中,无明显变化,说明铜在冷的浓硫酸中发生钝化 | |
| C. | Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 | |
| D. | 分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
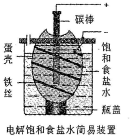 某化学课外学习小组设计电解饱和食盐水的简易装置如图(蛋壳内及壳外容器均充满饱和食盐水).有关说法正确的是( )
某化学课外学习小组设计电解饱和食盐水的简易装置如图(蛋壳内及壳外容器均充满饱和食盐水).有关说法正确的是( )| A. | 通电一段时间后,往蛋壳内溶液中滴加几滴酚酞,呈红色 | |
| B. | 蛋壳表面缠绕的铁丝发生氧化反应 | |
| C. | 碳棒上产生的气体能使湿润的淀粉碘化钾试纸变蓝 | |
| D. | 电解一段时间后,蛋壳外溶液的pH下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ⑤$\stackrel{+2}{M}g$( )
⑤$\stackrel{+2}{M}g$( )| A. | ①② | B. | ②④ | C. | ③④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 这种饮料中不含任何化学物质 | |
| B. | 这种蒸馏水绝对纯净,不含任何离子 | |
| C. | 这种口服液含有丰富的氮、磷、锌等微量元素 | |
| D. | 没有水就没有生命 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com