
硝酸是一种具有强氧化性的酸,它不仅能与活泼金属发生反应,也能与许多不活泼金属发生反应。其中金属铜与稀硝酸反应的化学方程式为3Cu+8HNO3(稀)===3Cu(NO3)2+2X↑+4H2O,则X的化学式为( )
A.NO2 B.NO
C.N2O D.N2O4
科目:高中化学 来源: 题型:
利用下图装置可实现在铜片上镀镍,下列有关说法不正确的是

A.a为正极,d极为铜片
B.甲池是燃料电池、乙池是电镀池
C.b极上发生的电极反应为:CH4+10OH――8e-=CO32-+7H2O
D.c极上发生的电极反应为: Ni2+ + 2e-= Ni
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的应用正确的是( )
A.液氨汽化时要吸收大量的热,可用作制冷剂
B.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
C.生石灰能与水反应,可用来干燥氯气
D.氯化铝是一种电解质,可用于电解法制铝
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色气体可能含HCl、HBr、SO2、H2S中的一种或几种,将该气体通入到适量氯水中,恰好反应,无气体剩余。将所得到的无色溶液分装在两支试管中,分别加入酸化的AgNO3溶液和酸化的BaCl2溶液,均产生白色沉淀,则下列判断正确的为( )
A.原气体中一定有SO2,一定无HBr和H2S
B.原气体中可能有H2S
C.原气体中一定有HCl和SO2
D.不能确定有无HCl,但一定无SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应。二者比较,相等的是( )www.21-cn-jy.com
①铜片消耗完所需时间 ②反应生成的气体体积(标准状况) ③反应中氧化剂得到的电子总数 ④反应后溶液中铜离子的浓度
A.①③ B.②④
C.③④ D.只有①
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.01 mol下列物质分别加入100 mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)( )
①Na2O2 ②Na2O ③Na2CO3 ④NaCl
A.①>②>③>④ B.①>②>④>③
C.①=②>③>④ D.①=②>③=④
查看答案和解析>>
科目:高中化学 来源: 题型:
废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
Ⅰ.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向Ⅰ所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.……
(1)步骤Ⅰ中发生反应的化学方程式为________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2)步骤Ⅱ所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+。用离子方程式解释其可能的原因________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)步骤Ⅲ获得CuSO4溶液的离子方程式为________________________________________________________________________
________________________________________________________________________。
(4)步骤Ⅱ所得滤液经进一步处理可制得Na2FeO4,流程如下:



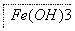


①测得滤液中c(Fe2+)为a mol·L-1,若要处理滤液,理论上需要消耗25%的H2O2溶液 68a kg(用含a的代数式表示)。2-1-c-n-j-y
②写出由Fe(OH)3制取Na2FeO4的化学方程式 2Fe(OH)3+3NaClO+4NaOH 2Na2FeO4+3NaCl+5H2O 。
查看答案和解析>>
科目:高中化学 来源: 题型:
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
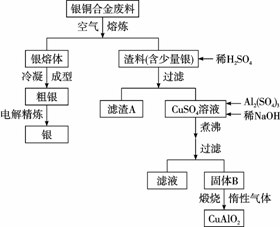
[注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃]
(1)电解精炼银时,阴极反应式为 Ag++e- Ag ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 2NO+O2 2NO2 。
(2)固体混合物B的组成为 Al(OH)3和CuO ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 Al(OH)3+OH- AlO +2H2O 。2·1·c·n·j·y
+2H2O 。2·1·c·n·j·y
(3)完成煅烧过程中一个反应的化学方程式:
4 CuO+ 2 Al2O3 4 CuAlO2+ O2 ↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0 kg废料中的铜可完全转化为 50 mol CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液 25.0 L。www.21-cn-jy.com
(5)CuSO4溶液也可用于制备胆矾,其基本操作是 蒸发浓缩、冷却结晶 、过滤、洗涤和干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示方法正确的是( )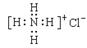


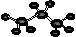 ① H2S分子的比例模型: ② NH4Cl电子式:
① H2S分子的比例模型: ② NH4Cl电子式:
③ 苯乙醛结构简式: ④ 丙烷分子的球棍模型:
A.①④ B.①②④ C.①②③④ D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com