
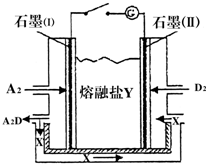
·ÖĪö ŌŚĶŁŅŗÖŠ“ęŌŚĻĀĮŠĘ½ŗā£ŗCa5£ØPO4£©3OH£Øs£©?3PO43-+5Ca2++OH-£¬ŅĄ¾Ż³ĮµķČܽāĘ½ŗāµÄÓ°ĻģŅņĖŲ·ÖĪö£¬ĘäĘ½ŗāæÉŅŌ·ÖĪö³öĖį»į“Ł½ųĘäµēĄė¶ųČܽā£¬Ōģ³ÉČ£³Ż£®
½ā“š ½ā£ŗCa5£ØPO4£©3OHŌŚĶŁŅŗÖŠ“ęŌŚĻĀĮŠĘ½ŗā·“Ó¦£ŗCa5£ØPO4£©3OH£Øs£©?5Ca2+£Øaq£©+3PO43-£Øaq£©+OH-£Øaq£©£¬½ųŹ³ŗóĻø¾śŗĶĆø×÷ÓĆÓŚŹ³Īļ²śÉśÓŠ»śĖį£¬ÓŠ»śĖįÓėOH-·“Ó¦£¬H++OH-=H2O£¬Ź¹³ĮµķČܽāĘ½ŗāĻņÓŅŅĘ¶Æ£¬µ¼ÖĀCa5£ØPO4£©3OHČܽā£¬Ōģ³ÉČ£³Ż£»
¹Ź“š°øĪŖ£ŗÓŠ»śĖįÖŠŗĶĮĖĒāŃõøł£¬H++OH-=H2O£¬Ōģ³ÉOH-ÅØ¶Č½µµĶ£¬“ŁŹ¹Ę½ŗāÕżĻņŅĘ¶Æ£¬½«øĘ»ÆĪļ·Ö½ā£¬ŃĄ³Ż±»øÆŹ“£®
µćĘĄ ±¾Ģāæ¼²éĮĖ³ĮµķČܽāĘ½ŗāµÄÓ°ĻģŅņĖŲµÄ·ÖĪöÅŠ¶Ļ£¬ÓŠ»śĖįĖį»į“Ł½ųĘ½ŗāÕżĻņ½ųŠŠ£¬ĢāÄæÄŃ¶Č²»“ó£®


 Š”ѧ¶į¹ŚAB¾ķĻµĮŠ“š°ø
Š”ѧ¶į¹ŚAB¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 A”¢B”¢C”¢D”¢E”¢F”¢G”¢H°ĖÖÖŌŖĖŲ·Ö²¼ŌŚČżøö²»Ķ¬µÄ¶ĢÖÜĘŚ£¬ĖüĆĒµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬ĘäÖŠB”¢C”¢DĪŖĶ¬Ņ»ÖÜĘŚ£¬AÓėE£¬BÓėG£¬DÓėH·Ö±šĪŖĶ¬Ņ»Ö÷×壬CŗĶDµÄ×īĶā²ćµē×ÓŹżÖ®ŗĶĪŖ11£¬C”¢D”¢FČżÖÖŌŖĖŲµÄŌ×ÓŠņŹżÖ®ŗĶĪŖ28£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
A”¢B”¢C”¢D”¢E”¢F”¢G”¢H°ĖÖÖŌŖĖŲ·Ö²¼ŌŚČżøö²»Ķ¬µÄ¶ĢÖÜĘŚ£¬ĖüĆĒµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬ĘäÖŠB”¢C”¢DĪŖĶ¬Ņ»ÖÜĘŚ£¬AÓėE£¬BÓėG£¬DÓėH·Ö±šĪŖĶ¬Ņ»Ö÷×壬CŗĶDµÄ×īĶā²ćµē×ÓŹżÖ®ŗĶĪŖ11£¬C”¢D”¢FČżÖÖŌŖĖŲµÄŌ×ÓŠņŹżÖ®ŗĶĪŖ28£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 5 | B£® | 6 | C£® | 7 | D£® | 8 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  | B£® |  | C£® | 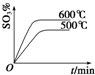 | D£® | 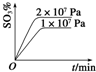 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2 mol•L-1 KClČÜŅŗÓė1 mol•L-1 K2SO4ČÜŅŗµČĢå»ż»ģŗĻŗó£¬c£ØK+£©ĪŖ2 mol•L-1 | |
| B£® | 120 g NaClČÜŅŗÖŠČÜÓŠ20 g NaCl£¬øĆĪĀ¶ČĻĀNaClµÄČܽā¶ČĪŖ20 g | |
| C£® | 22.4 L HClĘųĢåČÜÓŚĖ®ÖĘ³É1 LČÜŅŗ£¬øĆČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖ1 mol•L-1 | |
| D£® | °Ń5 gµØ·ÆČÜÓŚ45 gĖ®ÖŠ£¬ĖłµĆČÜŅŗČÜÖŹµÄÖŹĮæ·ÖŹżĪŖ10% |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ę½ŗāĻņÓŅŅĘ¶Æ | B£® | AµÄĢå»ż·ÖŹż±ČŌĘ½ŗāŹ±Š” | ||
| C£® | AµÄ×Ŗ»ÆĀŹŌö“ó | D£® | Õż·“Ó¦ĖŁĀŹŌö“ó£¬Äę·“Ó¦ĖŁĀŹ¼õŠ” |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
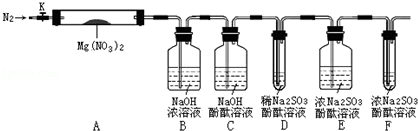
 £¬²½Öč¢ņÖŠ£¬ĶØČėŅ»¶ĪŹ±¼äN2µÄÄæµÄŹĒ±ÜĆā¶Ō·Ö½ā²śĪļO2µÄ¼ģŃé²śÉśøÉČÅ£®
£¬²½Öč¢ņÖŠ£¬ĶØČėŅ»¶ĪŹ±¼äN2µÄÄæµÄŹĒ±ÜĆā¶Ō·Ö½ā²śĪļO2µÄ¼ģŃé²śÉśøÉČÅ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
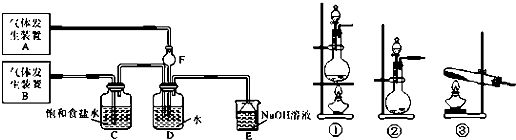
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.21 mol | B£® | 0.25 mol | C£® | 0.3 mol | D£® | 0.35mol |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com