
| A. | Cu(OH)2=Cu2++2 OH- | B. | NH3•H2O?NH4++OH- | ||
| C. | HF=H++F- | D. | H3PO43?3H++PO43- |
分析 A.氢氧化铜为弱电解质,部分电离用可逆号;
B.一水合氨为弱电解质,部分电离;
C.氢氟酸为弱酸,部分电离,用可逆号;
D.磷酸为多元弱酸,分步电离,以第一步为主.
解答 解:A.氢氧化铜为弱电解质,部分电离用可逆号,电离方程式:Cu(OH)2 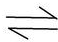 Cu2++2 OH-,故A错误;
Cu2++2 OH-,故A错误;
B.一水合氨为弱电解质,部分电离,电离方程式:NH3•H2O  NH4++OH-,故B正确;
NH4++OH-,故B正确;
C.氢氟酸为弱酸,部分电离,电离方程式:HF  H++F-,故C错误;
H++F-,故C错误;
D.磷酸为多元弱酸,分步电离,以第一步为主,电离方程式:H3PO4  H++H2PO4-,故D错误;
H++H2PO4-,故D错误;
故选:B.
点评 本题考查了电解质的电离方程式的书写,明确电解质强弱是解题关键,注意弱电解质部分电离,用可逆符号.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①② | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液呈中性的盐一定是强酸、强碱生成的盐 | |
| B. | 含有弱酸根盐的水溶液一定呈碱性 | |
| C. | 盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱 | |
| D. | 强酸强碱盐的水溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 LCl2中含有的共价键数 | |
| B. | 100g质量分数为16.2%HBr溶液中的氢原子数 | |
| C. | 3.9g Na202晶体中所含的离子总数 | |
| D. | 0.1mol H2S和0.1 mol SO2混合后,体系中的硫原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
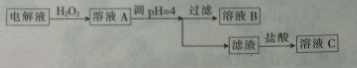
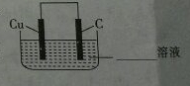
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com