
| A. | 盛放食醋 | B. | 烧煮开水 | C. | 盛放咸的食物 | D. | 用碱水洗涤 |
科目:高中化学 来源: 题型:解答题
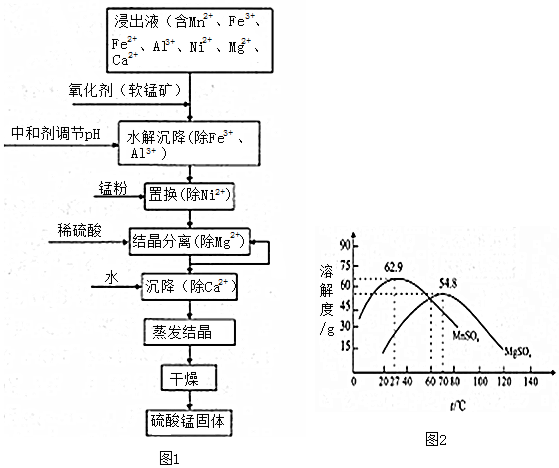
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (CN)2、(OCN)2、(SCN)2 等被称为拟卤素,可分别由CN-、OCN-、SCN-等氧化得到.
(CN)2、(OCN)2、(SCN)2 等被称为拟卤素,可分别由CN-、OCN-、SCN-等氧化得到.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
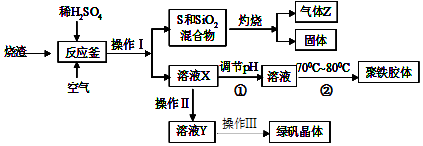
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( )
如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( )| A. | 外电路的电流方向为:X→外电路→Y | |
| B. | 若两电极分别为 Zn 和碳棒,则 X 为碳棒,Y 为 Zn | |
| C. | 若两电极都是金属,则它们的活动性为 X>Y | |
| D. | X 极上发生的是还原反应,Y 极上发生的是氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HCl>H2S>H2O | B. | 碱性:NaOH>KOH>Mg(OH)2 | ||
| C. | 酸性:HClO4>HBrO4>HIO4 | D. | 还原性:I-<Br-<Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
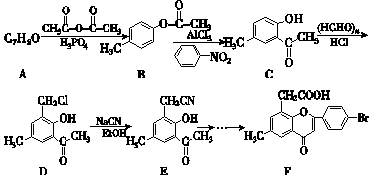
 +2NaOH→
+2NaOH→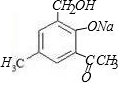 +H2O+NaCl.
+H2O+NaCl.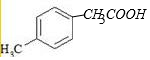 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4-、Al3+ | |
| B. | pH=2的溶液中可能大量存在Na+、NH4+、SiO32-、CO32- | |
| C. | 含有大量AlO2-的溶液中:K+、HCO3-、Br-、Na+可共存 | |
| D. | 在某钠盐溶液中含有等物质的量的Cl-、I-、AlO2-、CO32-、NO3-、SiO32-中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,最终溶液中无沉淀,阴离子种数减少3种,则原溶液中一定有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 L二氧化碳分解生成2 L一氧化碳和1 L氧气吸收576 kJ热量 | |
| B. | 恒压条件下生成物的总焓大于反应物的总焓 | |
| C. | 在相同条件下,2 mol一氧化碳与1 mol氧气的能量总和大于2 mol二氧化碳的能量 | |
| D. | 一氧化碳的燃烧热是566 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com